题目内容
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构.下列推测不正确的是( )
| A、同周期元素中X的金属性最强 |
| B、同周期元素中Y的最高价含氧酸的酸性最强 |
| C、原子半径X>Y,离子半径X+>Z2- |
| D、同族元素中Z的氢化物稳定性最高 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y在同一周期,X+与Z2-具有相同的核外电子层结构,可推Z在X、Y的上一个周期,又因为X、Y、Z原子序数之和为36,平均原子序数为12,则X为Na、Z为O、进而可知Y为Cl,结合元素周期律的递变规律解答该题.
解答:
解:X、Y在同一周期,X+与Z2-具有相同的核外电子层结构,可推Z在X、Y的上一个周期,又因为X、Y、Z原子序数之和为36,平均原子序数为12,则X为Na、Z为O、进而可知Y为Cl,则
A、X为Na,由同周期元素从左到右元素的金属性逐渐减弱可知同周期元素中X的金属性最强,故A正确;
B、同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性逐渐增强,故B正确;
C、具有相同的核外电子层结构的离子,核电核数越大,半径越小,则离子半径应为:Z2->X+,故C错误;
D、Z的氢化物为H2O,含有氢键,常温下为液态,同族元素中Z的氢化物稳定性最高,故D正确;
故选C.
A、X为Na,由同周期元素从左到右元素的金属性逐渐减弱可知同周期元素中X的金属性最强,故A正确;
B、同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性逐渐增强,故B正确;
C、具有相同的核外电子层结构的离子,核电核数越大,半径越小,则离子半径应为:Z2->X+,故C错误;
D、Z的氢化物为H2O,含有氢键,常温下为液态,同族元素中Z的氢化物稳定性最高,故D正确;
故选C.
点评:本题考查元素的推断和元素周期律,题目难度中等,注意把握元素的推断的角度以及元素周期律的递变规律.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、由水电离产生的C(H+)=10-13mol/L的溶液中:K+、Na+、SO32-、S2- | ||
| B、1.0mol?L-1KNO3溶液:H+、Fe2+、Cl-、SO42- | ||
C、
| ||
| D、过量氨水中:Ag+、Na+、K+、NO3- |
一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g)
下列说法正确的是( )
下列说法正确的是( )
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A、该反应的正方应为吸热反应 |
| B、达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小 |
| C、容器I中反应达到平衡所需时间比容器Ⅲ中的长 |
| D、若起始时向容器I中充入CH3OH 0.1mol、CH3OCH30.15mol和H2O 0.10mol,则反应将向正反应方向进行 |
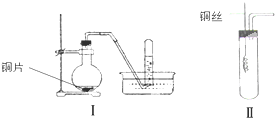 如图是铜与稀硝酸反应的两个实验装置图,请回答下列问题:
如图是铜与稀硝酸反应的两个实验装置图,请回答下列问题: 请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):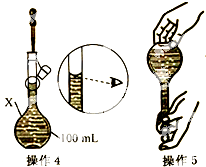 某同学欲配制100mL 0.10mol/L CuSO4溶液.以下操作1~5是其配制过程及示意图:
某同学欲配制100mL 0.10mol/L CuSO4溶液.以下操作1~5是其配制过程及示意图: