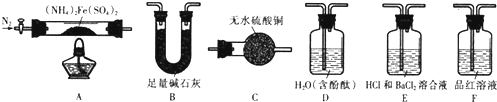
题目内容
18.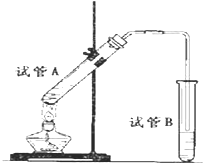 如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.
如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.(1)写出制备乙酸乙酯的化学方程式CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O.
(2)浓硫酸在实验中的作用是催化剂、吸水剂.
(3)加热一段时间后,在试管B饱和碳酸钠溶液的液面上方有一层油层,在油、水交界处观察到有气泡产生,气泡的主要成分是CO2.
(4)停止加热,取下试管B,嗅闻管内液体气味,闻到更多的是刺激性气味,这是因为物质的挥发等因素导致产品混有杂质,如乙醇和乙酸等,故试管B中加饱和碳酸钠溶液,反应结束后,倾倒出油状液体,再进行蒸馏(填提纯的操作方法),收集74~78℃的馏分即可获得较纯净的乙酸乙酯.
(5)装置中通蒸气的导管要伸到饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止倒吸.
分析 (1)乙醇与乙酸发生酯化反应生成乙酸乙酯;
(2)该反应为可逆反应,浓硫酸可吸收水,可作催化剂;
(3)碳酸钠与乙酸反应生成气体;
(4)乙醇、乙酸均易挥发,加碳酸钠溶液吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度,分液后,再蒸馏收集74~78℃的馏分即可获得较纯净的乙酸乙酯;
(5)因乙酸、乙醇易溶于水,通蒸气的导管要伸到饱和碳酸钠溶液的液面上,不能插入溶液中,防止倒吸.
解答 解:(1)实验室利用乙酸和乙醇制备乙酸乙酯,反应的化学方程式为CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;
(2)该反应为可逆反应,浓硫酸可吸收水,可作催化剂,浓硫酸在实验中的作用是催化剂、吸水剂,
故答案为:催化剂;吸水剂;
(3)加热一段时间后,在试管B饱和碳酸钠溶液的液面上方有一层油层,在油、水交界处观察到有气泡产生,为碳酸钠与乙酸反应生成二氧化碳,则气泡的主要成分是CO2,故答案为:CO2;
(4)停止加热,取下试管B,嗅闻管内液体气味,闻到更多的是刺激性气味,这是因为物质的挥发等因素导致产品混有杂质,如乙醇和乙酸等,故试管B中加 饱和碳酸钠溶液,反应结束后,倾倒出油状液体,再进行蒸馏,收集74~78℃的馏分即可获得较纯净的乙酸乙酯,
故答案为:乙醇;乙酸;饱和碳酸钠溶液;蒸馏;乙酸乙酯;
(5)装置中通蒸气的导管要伸到饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止倒吸,
故答案为:倒吸.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意有机物的性质,题目难度不大.

 ABC考王全优卷系列答案
ABC考王全优卷系列答案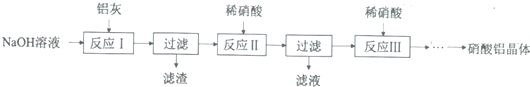
完成下列填空:
(1)用NaOH固体配制30%的NaOH溶液,所需的玻璃仪器除烧杯外,还有b.
a容量瓶 b量筒 c.烧瓶
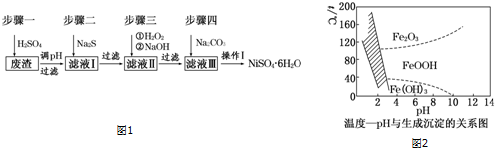
(2)反应Ⅱ中为避免铝的损失,需要解决的问题是如何控制反应终点(或硝酸的用量).
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干.
(4)有人建议将反应Ⅱ、Ⅲ合并以简化操作,说明工业上不采用这种方法的原因产物中杂质NaNO3的含量较高.
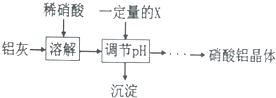
(5)某同学在实验室用铝灰制各硝酸铝晶体,其流程如下:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |
为使得到的硝酸铝晶体较纯净,所用的X物质可以是BC(填编号).
A.氨水 B.铝 c.氢氧化铝 D.偏铝酸钠
(6)该实验室制法与工业上制法相比,其缺点是产生大量污染性气体NO等.
(7)称取7.392g硝酸铝晶体样品,加热灼烧使其分解完全,最终得到1.020gAl2O3,计算硝酸铝晶体样品中结晶水的数目为8.7.

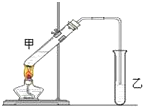 俗话说:“陈酒老醋特别香”,其原因是酒在存储过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示装置来模拟该过程,请回答下列问题:
俗话说:“陈酒老醋特别香”,其原因是酒在存储过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示装置来模拟该过程,请回答下列问题: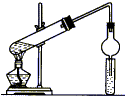 用如图所示装置制取乙酸乙酯,请回答以下问题.
用如图所示装置制取乙酸乙酯,请回答以下问题.