题目内容
7.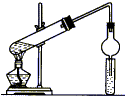 用如图所示装置制取乙酸乙酯,请回答以下问题.
用如图所示装置制取乙酸乙酯,请回答以下问题.(1)导气管连接球形干燥管插入Na2CO3溶液中,除了冷凝作用外,另一个重要作防止倒吸;
(2)浓H2SO4的作用是催化剂、吸水剂;
(3)饱和Na2CO3溶液的作用除了降低乙酸乙酯的溶解度和除去乙醇外,还有乙酸.
分析 (1)球形干燥管的球形结构,可防止试管中的液体被倒吸进入试管中;
(2)该反应为酯化反应,且浓硫酸具有脱水性;
(3)碳酸钠溶液吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度.
解答 解:(1)导气管连接球形干燥管插入Na2CO3溶液中,除了冷凝作用外,另一个重要作防止倒吸,
故答案为:防止倒吸;
(2)该反应为酯化反应,且浓硫酸具有脱水性,则浓硫酸的作用为催化剂、吸水剂,
故答案为:催化剂、吸水剂;
(3)饱和Na2CO3溶液的作用除了降低乙酸乙酯的溶解度和除去乙醇外,还有除去乙酸,
故答案为:除去乙酸.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意有机物的性质,题目难度不大.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
4.在恒温条件下,欲使CH3COONa稀溶液中,$\frac{{c(C{H_3}CO{O^-})}}{{c(N{a^+})}}$比值增大,可在溶液中加入少量下列物质中的( )
①固体NaOH
②固体KOH
③固体 CH3COONa
④冰醋酸.
①固体NaOH
②固体KOH
③固体 CH3COONa
④冰醋酸.
| A. | 只有①② | B. | 只有②④ | C. | 只有②③④ | D. | 只有①④ |
15.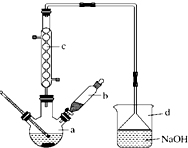 溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴. 向a中滴入几滴溴,有白色烟雾产生,是因为生成了HBr气体.继续滴加至液溴滴完.装置d的作用是吸收HBr和Br2;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是吸水(干燥);
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C;(填入正确选项前的字母)
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B.(填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL.
 溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤,NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是吸水(干燥);
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为苯,要进一步提纯,下列操作中必须的是C;(填入正确选项前的字母)
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是B.(填入正确选项前的字母)
A.25mL B.50mL C.250mL D.500mL.
2.正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.
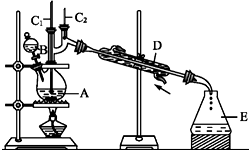
发生的反应如下:
CH3CH2CH2CH2OH$→_{H_{2}SO_{4},△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
实验步骤如下:
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸气出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,容易发生迸溅.
(2)加入沸石的作用是防止暴沸.若加热后发现未加沸石,应采取的正确方法是冷却后补加.
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是C(填正确答案标号).
A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”).
(6)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化
(7)本实验中,正丁醛的产率为51%.

发生的反应如下:
CH3CH2CH2CH2OH$→_{H_{2}SO_{4},△}^{Na_{2}Cr_{2}O_{7}}$CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
将6.0g Na2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸气出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.0g.
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,容易发生迸溅.
(2)加入沸石的作用是防止暴沸.若加热后发现未加沸石,应采取的正确方法是冷却后补加.
(3)上述装置图中,B仪器的名称是分液漏斗,D仪器的名称是直形冷凝管.
(4)分液漏斗使用前必须进行的操作是C(填正确答案标号).
A.润湿 B.干燥 C.检漏 D.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在下层(填“上”或“下”).
(6)反应温度应保持在90~95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化
(7)本实验中,正丁醛的产率为51%.
12.化学反应N2(g)+3H2(g)═2NH3(l)的能量变化如图所示,则该反应的△H等于( )

| A. | +2(a-b-c) kJ•mol-1 | B. | +2(b-a) kJ•mol-1 | ||
| C. | +(b+c-a) kJ•mol-1 | D. | +(a+b) kJ•mol-1 |
19.已知:常温下浓度为0.1moL•L-的下列溶液的pH如下表.下列有关说法正确的是( )
| 溶质 | NaF | CH3COONa | Na2S |
| pH | 7.5 | 9.5 | 11.8 |
| A. | 根据如,NaF的水解程度比CH3COONa的大 | |
| B. | 同体积、同pH的两种酸溶液消耗同浓度NaOH的体积:HF>CH3COOH | |
| C. | 向100mL 0.1 mol•L-1 CH3COONa溶液中通入224mL HF气体(标准状况):c(CH3COOH)+c(H+)═c(OH-)+c(F-) | |
| D. | 若将0.05 mol HC1缓慢地通入1 L 0.1 moL•L-Na2S溶液中,则溶液中离子浓度大小为:c(Cl-)>c(HS-)>c(OH-)c(S2-)>c(H+) |
17.下列除去杂质(括号内的物质为杂质)的方法中错误的是( )
| A. | FeSO4(CuSO4):加足量铁粉后,过滤 | |
| B. | CO(CO2):用NaOH溶液洗气后干燥 | |
| C. | MnO2(KCl):加水溶解后,过滤、洗涤、烘干 | |
| D. | N2(O2):通过灼热的氧化铜 |
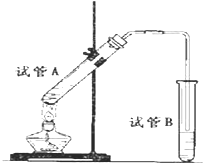 如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.
如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.