题目内容
物质灼烧时,焰色反应为黄色,下列判断正确的是( )
| A、该物质一定是钠的化合物 |
| B、该物质一定含钠元素,不能确定是否含有K元素 |
| C、该物质一定是金属钠 |
| D、该物质一定只含钠元素 |
考点:焰色反应
专题:元素及其化合物
分析:根据焰色反应是元素的性质与元素的存在形态无关,可能是含钠化合物,也可能是单质,钾元素的焰色反应为紫色,易被黄光遮住,据此来分析解答.
解答:
解:A.焰色反应的性质是元素的性质,与元素的存在形态无关,可能是含钠化合物,也可能是单质,故A错误;
B.钾元素的焰色反应为紫色,易被黄光遮住,某物质灼烧时,焰色反应为黄色,所以一定含有钠元素,不能确定是否含有K元素,故B正确;
C.焰色反应的性质是元素的性质,与元素的存在形态无关,可能是含钠化合物,也可能是单质,故C错误;
D.钾元素的焰色反应为紫色,易被黄光遮住,某物质灼烧时,焰色反应为黄色,所以一定含有钠元素,不能确定是否含有K元素,故D错误,
故选B.
B.钾元素的焰色反应为紫色,易被黄光遮住,某物质灼烧时,焰色反应为黄色,所以一定含有钠元素,不能确定是否含有K元素,故B正确;
C.焰色反应的性质是元素的性质,与元素的存在形态无关,可能是含钠化合物,也可能是单质,故C错误;
D.钾元素的焰色反应为紫色,易被黄光遮住,某物质灼烧时,焰色反应为黄色,所以一定含有钠元素,不能确定是否含有K元素,故D错误,
故选B.
点评:本题考查焰色反应,难度不大.明确焰色反应是元素的性质是解答的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 热激活电池可用作火箭、导弹的工作电源.其基本结构如图所示,作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca?CaCl2+Li2SO4+Pb.下列有关说法正确的是( )
热激活电池可用作火箭、导弹的工作电源.其基本结构如图所示,作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能.该电池的总反应方程式为:PbSO4+2LiCl+Ca?CaCl2+Li2SO4+Pb.下列有关说法正确的是( )| A、电子由钙电极流出经无水LiCl-KCl电解质流向硫酸铅电极 |
| B、常温时,在正负极间接上电流表或检流计,指针不偏转 |
| C、放电过程中,Li+向负极移动 |
| D、每转移0.1mol电子,理论上生成20.7g Pb |
有四种氯化物,它们的通式为XCl2,其中最可能是第IIA族元素的氯化物是( )
| A、白色固体,熔点低,完全溶于水,得到一种无色中性溶液,此溶液导电性差 |
| B、绿色固体,熔点高,易被氧化,得到一种蓝绿色溶液,此溶液具有良好的导电性 |
| C、白色固体,极易升华,如与水接触,可慢慢分解 |
| D、白色固体,熔点较高,易溶于水,得无色中性溶液,此溶液具有良好的导电性 |
下列说法中不正确的是( )
| A、维生素C具有还原性,在人体内起抗氧化作用 |
| B、为防止月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁 |
| C、由水电离出来的c(H+)=1×10-13mol/L的溶液中:K+、CO32-、Cl-、NO3-可能大量共存 |
| D、使石蕊变红的溶液中:Na+、I-、Cl-、NO3-可能大量共存 |
某工业生产经过以下转化步骤:
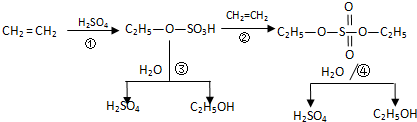
下列说法中不正确的是( )

下列说法中不正确的是( )
| A、该过程中③、④是酯类的水解反应 |
| B、该过程中硫酸是催化剂 |
| C、该过程中①、②是加成反应 |
| D、该过程是一种新的硫酸生产方法 |
室温下,0.1mol?L-1 HF溶液与0.1mol?L-1 NaOH溶液等体积混合(忽略混合前后溶液体积的变化),则下列有关混合后的溶液中离子浓度的叙述正确的是( )
| A、由水电离产生的c(H+)为1.0×10-7mol?L-1 |
| B、c(F-)+c(HF)=c(Na+) |
| C、升高温度,c(F-)增大 |
| D、c(F-)>c(Na+)>c(H+)>c(OH-) |
下列说法正确的是(NA表示阿伏加德罗常数的数值)( )
| A、在常温常压下,11.2 L N2含有的分子数为0.5 NA |
| B、22.4L Cl2所含原子数为2NA |
| C、在常温常压下,1 mol Ne含有的原子数为NA |
| D、在同温同压时,相同体积的任何气体单质所含的原子数相同 |
下列各组溶液,同时开始反应,出现浑浊最早的是( )
| A、20℃时5mL 0.05mol?L-1 Na2S2O3溶液与5mL 0.1mol?L-1硫酸混合 |
| B、20℃时 50mL0.1mol/L Na2S2O3溶液与50mL 0.1mol?L-1硫酸混合 |
| C、10℃时5mL 0.05mol?L-1 Na2S2O3溶液与5mL 0.1mol?L-1硫酸混合 |
| D、10℃时 5mL 0.1mol?L-1 Na2S2O3溶液与5mL 0.1mol?L-1硫酸混合 |