题目内容
将SO2气体通入BaCl2溶液至饱和,无沉淀生成,再通入另一种气体仍没有沉淀生成,则第二次通入的气体可能是下列气体中的( )
①NO2 ②CO2③Cl2 ④HCl ⑤NH3 ⑥H2S.
①NO2 ②CO2③Cl2 ④HCl ⑤NH3 ⑥H2S.
| A、②④⑥ | B、①⑤⑥ |
| C、②④ | D、②③⑤ |
考点:二氧化硫的化学性质
专题:氧族元素
分析:将SO2通入BaCl2溶液中 如生成沉淀,应有两种情况,一是溶液中有较多的SO32-离子,或发生氧化还原反应生成SO42-离子,或者生成其它沉淀,例如与H2S反应生成S沉淀,以此来解答.
解答:
解:①通NO2,与二氧化硫发生氧化还原反应生成硫酸根离子,生成硫酸钡沉淀,故不选;
②通CO2仍不能反应,不会生成沉淀,故选;
③通Cl2,与二氧化硫发生氧化还原反应生成硫酸根离子,生成硫酸钡沉淀,故不选;
④通HCl仍不能反应,不会生成沉淀,故选;
⑤通NH3,与二氧化硫发生生成亚硫酸铵,与氯化钡反应生成亚硫酸钡沉淀,故不选;
⑥通入H2S发生S02+2H2S═3S↓+2H2O,生成S沉淀,故不选;
故选C.
②通CO2仍不能反应,不会生成沉淀,故选;
③通Cl2,与二氧化硫发生氧化还原反应生成硫酸根离子,生成硫酸钡沉淀,故不选;
④通HCl仍不能反应,不会生成沉淀,故选;
⑤通NH3,与二氧化硫发生生成亚硫酸铵,与氯化钡反应生成亚硫酸钡沉淀,故不选;
⑥通入H2S发生S02+2H2S═3S↓+2H2O,生成S沉淀,故不选;
故选C.
点评:本题二氧化硫的性质,题目难度不大,侧重SO2的酸性、还原性的考查,把握发生的化学反应为解答的关键,注重基础知识夯实.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
下列说法不正确的是( )
| A、利用盖斯定律可计算某些难以直接测量的反应焓变 |
| B、如果一个化学方程式通过其他几个化学方程式相加减而得到,则该反应的焓变可由相关的化学方程式的焓变相加减而得到 |
| C、对于放热反应,放出的热量越多,焓变越小 |
| D、当同一个化学反应以不同的过程完成时,反应的焓变是不同的 |
分析如面的能量变化示意图,确定下列选项中正确的是( )
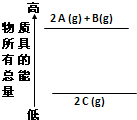

| A、2 A(g)+B(g)=2 C(g);△H<0 |
| B、2 A(g)+B(g)=2 C(g);△H>0 |
| C、2A+B=2 C;△H<0 |
| D、2C=2 A+B;△H<0 |
 如图,关闭活塞K,向A中充入1mol X、1mol Y,向B中充入2mol X、2mol Y,此时A、B的容积都是a L.在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L.下列说法正确的是( )
如图,关闭活塞K,向A中充入1mol X、1mol Y,向B中充入2mol X、2mol Y,此时A、B的容积都是a L.在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L.下列说法正确的是( )| A、反应速率:v(B)<v(A) |
| B、A 容器中X的转化率为80% |
| C、平衡时的压强:2p(A)=p(B) |
| D、平衡时Y的体积分数:A>B |
2008年5月8日上午9时17分,北京奥运火炬祥云首次成功点亮在世界最高峰--珠峰,将奥运火送上珠峰,是一项艰巨和复杂的事情,对技术要求很高,充分体现了北京奥运会的“绿色奥运、科技奥运和人文奥运”的理念.北京奥运火炬的外壳主要采用高品质的铝合金材料制造,燃烧系统内装环保型燃料--丙烷.其下列对丙烷有关说法中不正确的是( )
| A、分子中碳原子不在一条直线上 |
| B、光照下能够发生取代反应 |
| C、比丁烷更易液化 |
| D、是石油分馏的一种产品 |
下列说法正确的是( )
| A、PM 2.5(微粒直径约为2.5×10-6m)分散在空气中形成气溶胶而对人体产生危害 |
| B、明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
| C、地沟油对身体有害不能用作食用油,但可以在循环经济中发挥作用 |
D、塑化剂的基本结构为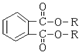 ,因此可以水解成对人体无害的物质 ,因此可以水解成对人体无害的物质 |
 元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )
元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中R单质在暗处与H2剧烈化合并发生爆炸.则下列判断正确的是( )| A、非金属性:T<X<R |
| B、气态氢化物稳定性:R<T<Q |
| C、R与Q的电子数相差16 |
| D、X与Q最高价氧化物的水化物的质子数相差18 |
下列有关叙述中正确的是( )
| A、碳酸钙在水里的溶解度很小,所以碳酸钙是弱电解质 |
| B、NH3的水溶液导电,所以NH3是电解质 |
| C、强电解质在水溶液中的电离过程是不可逆的 |
| D、强电解质的水溶液导电能力一定比弱电解质的水溶液导电能力强 |