题目内容
向100mL 1mol/L的Al2(SO4)3溶液中加入100mL NaOH溶液,得到7.8克白色沉淀,请问NaOH溶液物质的量浓度可能是多少?
考点:化学方程式的有关计算
专题:计算题
分析:溶液Al2(SO4)3的物质的量=0.1L×0.1mol/L=0.01mol,与NaOH反应完全转化为Al(OH)3,可得Al(OH)3的质量=0.01mol×2×78g/mol=15.6g>7.8g,由Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+2H2O,可知NaOH存在两种情况,一是NaOH不足,部分Al3+转化为Al(OH)3,二是Al3+全转化为Al(OH)3后,Al(OH)3部分溶解,以此计算.
解答:
解:反应得到7.8g氢氧化铝,其物质的量=
=0.1mol,
溶液Al2(SO4)3的物质的量=0.1L×0.1mol/L=0.01mol,与NaOH反应完全转化为Al(OH)3,可得Al(OH)3的质量=0.01mol×2×78g/mol=15.6g>7.8g,由Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+2H2O,可知NaOH存在两种情况:
一是NaOH不足,部分Al3+转化为Al(OH)3,则:
Al3++3OH-=Al(OH)3↓
0.3mol 0.1mol
故氢氧化钠溶液的物质的量浓度=
=3mol/L,
二是Al3+全转化为Al(OH)3后,Al(OH)3部分溶解,则:
Al3++3OH-=Al(OH)3↓
0.02mol 0.06mol 0.02mol
Al(OH)3+OH-=AlO2-+2H2O,
(0.02-0.01)mol 0.01mol
故氢氧化钠溶液的物质的量浓度=
=7mol/L,
答:氢氧化钠溶液的浓度为3mol/L或7mol/L.
| 7.8g |
| 78g/mol |
溶液Al2(SO4)3的物质的量=0.1L×0.1mol/L=0.01mol,与NaOH反应完全转化为Al(OH)3,可得Al(OH)3的质量=0.01mol×2×78g/mol=15.6g>7.8g,由Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+2H2O,可知NaOH存在两种情况:
一是NaOH不足,部分Al3+转化为Al(OH)3,则:
Al3++3OH-=Al(OH)3↓
0.3mol 0.1mol
故氢氧化钠溶液的物质的量浓度=
| 0.3mol |
| 0.1L |
二是Al3+全转化为Al(OH)3后,Al(OH)3部分溶解,则:
Al3++3OH-=Al(OH)3↓
0.02mol 0.06mol 0.02mol
Al(OH)3+OH-=AlO2-+2H2O,
(0.02-0.01)mol 0.01mol
故氢氧化钠溶液的物质的量浓度=
| 0.06mol+0.01mol |
| 0.1L |
答:氢氧化钠溶液的浓度为3mol/L或7mol/L.
点评:本题考查化学方程式的有关计算,根据沉淀的质量判断可能发生的反应是解题关键,侧重对学生的分析能力和计算能力的考查,题目难度中等.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
甲醛与单烯烃的混合物含氧的质量分数为x,则其含碳的质量分数是( )
A、
| ||
B、
| ||
C、
| ||
| D、无法确定 |
为了进一步改善北京地区的环境质量,下列做法不正确的是( )
| A、推广使用无磷洗衣粉 |
| B、使用清洁燃料的公交车 |
| C、减少含硫化石燃料的大量燃烧 |
| D、使用不易降解的一次性塑料餐具 |
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标况下的密度为0.76g?L-1;W的质子数是X、Y、Z、M四种元素质子数之和的
.下列说法正确的是( )
| 1 |
| 2 |
| A、由X、Y、Z、M四种元素形成的化合物一定有共价键 |
| B、原子半径:W>Z>Y>X>M |
| C、由X元素形成的单质一定是原子晶体 |
| D、XZ2、X2M2、W2Z2均为直线型的共价化合物 |
 已知元素A、B、C、D、E、F均属前四周期,且原子序数依次增大,A的p能级电子数是s能级电子数的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能级层均排满,且最外层电子数为1.请回答下列问题:
已知元素A、B、C、D、E、F均属前四周期,且原子序数依次增大,A的p能级电子数是s能级电子数的一半,C的基态原子2p轨道有2个未成对电子;C与D形成的化合物中C显正化合价;E的M层电子数是N层电子数的4倍,F的内部各能级层均排满,且最外层电子数为1.请回答下列问题: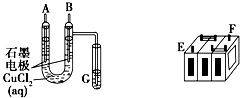 (Ⅰ)某铅蓄电池的正、负极标记被磨损.试用如图装置设计实验,识别出此铅蓄电池的正负极.
(Ⅰ)某铅蓄电池的正、负极标记被磨损.试用如图装置设计实验,识别出此铅蓄电池的正负极.