题目内容
13.下列离子方程式书写正确的是( )| A. | FeI2溶液中通入过量Cl2:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | |
| B. | 已知电离常数H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| D. | 等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O |
分析 A.氯气过量,亚铁离子和碘离子都完全被氧化,亚铁离子与碘离子的物质的量之比应该为1:2;
B.酸性HClO>HCO3-,二氧化碳与次氯酸钠溶液反应生成次氯酸和碳酸氢根离子;
C.氢氧化钠过量,铵根离子和碳酸氢根离子都参与反应;
D.二者物质的量相等时恰好反应生成碳酸钡沉淀、一水合氨和水.
解答 解:A.FeI2溶液中通入过量Cl2,反应生成氯化铁和碘单质,正确的离子方程式为:2Fe2++4I-+3Cl2═2Fe3++2I2+6Cl-,故A错误;
B.已知电离常数H2CO3>HClO>HCO3-,向NaClO溶液中通入少量CO2,二者反应生成碳酸氢钠和次氯酸,正确的离子方程式为:ClO-+CO2+H2O═HClO+HCO3-,故B错误;
C.NH4HCO3溶于过量的NaOH溶液,反应生成一水合氨、碳酸钠和水,正确的离子方程式为:HCO3-+NH4++2OH-=NH3•H2O+H2O+CO32-,故C错误;
D.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合,反应的离子方程式为:Ba2++2OH-+NH4++HCO3-═BaCO3↓+NH3•H2O+H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
11.常温下,下列各组离子或分子在指定溶液中能大量共存的是( )
| A. | 甲基橙呈红色的溶液中:MnO4-、Al3+、C2H5OH、SO${\;}_{4}^{2-}$ | |
| B. | c(NaHCO3)=0.1 mol•L-1的溶液中:K+、C6H5O-、SO${\;}_{4}^{2-}$、CO32- | |
| C. | 含有大量Fe2+的溶液:Na+、SO42+、NH4+、Fe(CN)63? | |
| D. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、S2? |
12.下图是应用电化学方法检测空气中SO2的原理示意图,下列有关说法不正确的是( )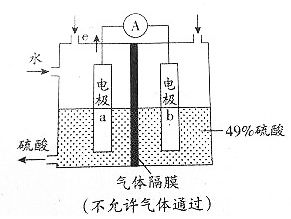

| A. | 该装置工作时能将化学能转化为电能,并有H2SO4生成 | |
| B. | 电极b表面O2发生还原反应,电极b附近溶液的pH升高 | |
| C. | 气体样品从电极a区域通入,样品中的SO2在电极a表面得到电子 | |
| D. | 电极a表面发生的电极反应时为SO2+2H2O-2e-=${SO}_{4}^{2-}$+4H+ |
5.某同学为了测定三聚氰胺的分子式和结构简式.设计了如下实验.他查阅资料得知:三聚氰胺的相对分子质量为126,三聚氰胺在常温下为晶体,在加热条件下能与氧气发生反应生成二氧化碳、氮气和水.现有12.6g三聚氰胺晶体按图所示实验装置反应(假设三聚氰胺完全转化成产物).
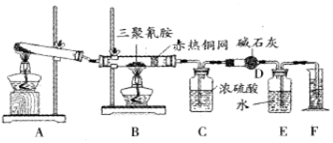
(1)写出A装置中发生反应的化学方程式:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑或2KMnO4$\frac{\underline{\;△\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)C装置能不能与D装置互换?不能,(填“能”或“不能”),理由是浓硫酸吸水,碱石灰吸收二氧化碳,若互换位置,则碱石灰会同时吸收水和二氧化碳,导致实验失败
(3)当B装置中反应完全发生后,读取F中水的体积,实验操作顺序为②③①(填序号).
①读数 ②冷却至室温 ③调平E、F装置中液面
(4)测定数据如表:
经测定,收集到的气体折合成标准状况下的体积为6.72L.
①利用上述实验数据,通过计算可知三聚氰胺的实验式为CN2H2.
②三聚氰胺的分子式为C3N6H6.
③若装置中没有铜网,则对测定结果的影响是测定所得分子式的氮原子数偏大,而碳、氢原子数偏小.
(5)已知氰酸(HCN)的结构简式为H-C≡N,氰胺的结构简式为H2N一C≡N,三聚氰胺分子中每个原子的最外层电子数均为8或2,则其结构简式为 .
.

(1)写出A装置中发生反应的化学方程式:2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑或2KMnO4$\frac{\underline{\;△\;}}{\;}$K2MnO4+MnO2+O2↑;
(2)C装置能不能与D装置互换?不能,(填“能”或“不能”),理由是浓硫酸吸水,碱石灰吸收二氧化碳,若互换位置,则碱石灰会同时吸收水和二氧化碳,导致实验失败
(3)当B装置中反应完全发生后,读取F中水的体积,实验操作顺序为②③①(填序号).
①读数 ②冷却至室温 ③调平E、F装置中液面
(4)测定数据如表:
| 仪器 | C | D |
| 实验前 | 101.0g | 56.0g |
| 试验后 | 106.4g | 69.2g |
①利用上述实验数据,通过计算可知三聚氰胺的实验式为CN2H2.
②三聚氰胺的分子式为C3N6H6.
③若装置中没有铜网,则对测定结果的影响是测定所得分子式的氮原子数偏大,而碳、氢原子数偏小.
(5)已知氰酸(HCN)的结构简式为H-C≡N,氰胺的结构简式为H2N一C≡N,三聚氰胺分子中每个原子的最外层电子数均为8或2,则其结构简式为
 .
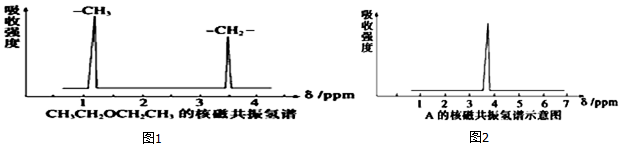
.  ,其核磁共振氢谱中有2个信号(参见图1).
,其核磁共振氢谱中有2个信号(参见图1).