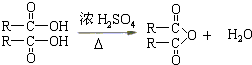
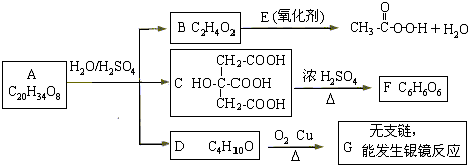
题目内容
 某温度时,有5L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据填空
某温度时,有5L的密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据填空(1)该反应的化学方程式为
(2)反应开始至2min,Y的平均反应速率为
(3)若X、Y、Z均为气体,反应达到平衡时:此时体系的压强是开始时的
考点:化学平衡的计算
专题:
分析:(1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)根据c=
计算反应速率;
(3)依据反应特点判断压强关系.
(2)根据c=
| △c |
| △t |
(3)依据反应特点判断压强关系.
解答:
解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
(2)反应开始至2min时Z的平均反应速率为:c(Y)=
=0.01mol/(L?min),
故答案为:0.01mol/(L?min);
(3)压强与气体物质的量成正比,开始n=1.0mol+1.0mol=2.0mol,平衡后n=0.9mol+0.7mol+0.2mol=1.8mol,故压强比为:1.8:2.0=0.9,故答案为0.9.
故答案为:3X+Y?2Z;
(2)反应开始至2min时Z的平均反应速率为:c(Y)=
| ||
| 2min |
故答案为:0.01mol/(L?min);
(3)压强与气体物质的量成正比,开始n=1.0mol+1.0mol=2.0mol,平衡后n=0.9mol+0.7mol+0.2mol=1.8mol,故压强比为:1.8:2.0=0.9,故答案为0.9.
点评:本题考查化学方程式的判断以及反应速率的计算,题目难度不大,注意图象题目中曲线的变化特点.

练习册系列答案
相关题目
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可以通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是( )
| ||
| A、KClO3在反应中失去电子 |
| B、ClO2是氧化产物 |
| C、H2C2O4在反应中被还原 |
| D、此反应中每生成1 mol ClO2转移的电子为1 mol |
下列实验能达到目的是( )
| A、用浓FeCl3溶液和NaOH溶液混合制备Fe(OH)3胶体 |
| B、将混有少量HCl的CO2通入饱和NaHCO3溶液中除去HCl |
| C、用湿润的pH试纸测定等浓度的Na2CO3和Na2SO3溶液的pH大小 |
| D、用AgNO3溶液鉴别Na2SO4溶液与NaCl溶液 |
符合如图中阴影部分的物质是( )


| A、Na2CO3 |
| B、Cu2(OH)2CO3 |
| C、NaCl |
| D、NaHSO4 |
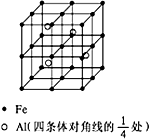 第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.
第四周期过渡元素Fe、Ti可与C、H、N、O形成多种化合物.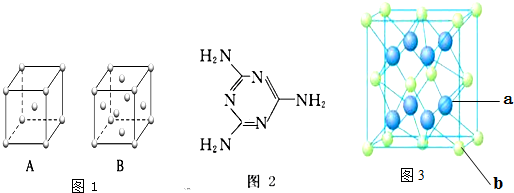
 结构,苯环上含有两个取代基,且在核磁共振氢谱中只出现4种峰的所有物质的结构简式为:
结构,苯环上含有两个取代基,且在核磁共振氢谱中只出现4种峰的所有物质的结构简式为: