题目内容
2.Na2O2可作为呼吸面具中的供氧剂,其供氧时主要反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑.分析 过氧化钠和二氧化碳反应生成碳酸钠和氧气,和水反应生成氢氧化钠和氧气,根据反应物和生成物书写方程式.
解答 解:过氧化钠和二氧化碳反应生成碳酸钠和氧气,和水反应生成氢氧化钠和氧气,根据反应物和生成物书写方程式为2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2↑.
点评 本题考查化学反应方程式的书写,为高频考点,熟悉物质性质是解本题关键,利用反应物和生成物书写方程式,注意:该反应中氧化剂和还原剂都是过氧化钠.

练习册系列答案
相关题目
10.有一种有机物结构简式为:HOCH2-CH=CHCH2COOCH2CH3,推测它不可能具有下列哪种性质( )
| A. | 常温下,能被酸性高锰酸钾溶液氧化 | |
| B. | 该分子最少有4个碳原子共平面 | |
| C. | 常温下,能在碱性条件下发生水解反应 | |
| D. | 常温下,能够与碳酸钠溶液反应生成CO2 |
14.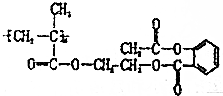 某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )
某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )
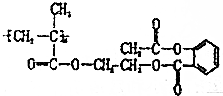 某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )
某药物的结构式如图所示,使其与含1.2g NaOH的溶液反应完全,消耗该药物的质量为( )| A. | 2.19n g | B. | 2.19g | C. | $\frac{2.92}{n}$g | D. | 2.92g |


 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据