题目内容
11.现有A、B、C、D、E、F六种短周期元素(稀有气体除外)原子序数依次增大,A、C同主族,在短周期中A元素的原子半径半径最小,B元素的原子最外层比次外层多3个电子,D元素的最高价氧化物对应的水化物M既可以与C最高价氧化物对应水化物N反应,又可以与E最高价氧化物对应水化物反应,E元素的单质为淡黄色固体.请据此填空:
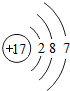
(1)写出以下元素符号:BOCNa,DAl,ES,FCl.F的原子结构示意图是
 ;
;(2)C、D最高价氧化物对应水化物的碱性强弱顺序NaOH>Al(OH)3,E、F最高价氧化物对应水化物的酸性强弱顺序H2SO4<HClO4.
(3)写出物质M与N的离子反应方程式Al(OH)3+OH-=AlO2-+2H2OE的氢化物水溶液中通入F单质的离子反应方程式H2S+Cl2=S↓+2Cl-+2H+.
分析 现有A、B、C、D、E、F六种短周期元素(稀有气体除外)原子序数依次增大,在短周期中A元素的原子半径半径最小,则A为H元素;B元素的原子最外层比次外层多3个电子,最外层最多含有8个电子,则B含有2个电子层,最外层含有6个电子,为O元素;A、C同主族,C的原子序数大于O元素,则C为Na元素;E元素的单质为淡黄色固体,则E为S元素;D元素的最高价氧化物对应的水化物M既可以与C最高价氧化物对应水化物N反应,又可以与E最高价氧化物对应水化物反应,则D的最高价氧化物对应的水合物为两性氢氧化物,则D为Al元素、M为Al(OH)3、N为NaOH;F的原子序数大于S,且为短周期元素,则F为Cl元素,据此进行解答.
解答 解:现有A、B、C、D、E、F六种短周期元素(稀有气体除外)原子序数依次增大,在短周期中A元素的原子半径半径最小,则A为H元素;B元素的原子最外层比次外层多3个电子,最外层最多含有8个电子,则B含有2个电子层,最外层含有6个电子,为O元素;A、C同主族,C的原子序数大于O元素,则C为Na元素;E元素的单质为淡黄色固体,则E为S元素;D元素的最高价氧化物对应的水化物M既可以与C最高价氧化物对应水化物N反应,又可以与E最高价氧化物对应水化物反应,则D的最高价氧化物对应的水合物为两性氢氧化物,则D为Al元素、M为Al(OH)3、N为NaOH;F的原子序数大于S,且为短周期元素,则F为Cl元素,
(1)根据分析可知,B为O、C为Na、D为Al、E为S、F为Cl元素;氯原子的核电荷数=核外电子总数=17,最外层含有7个电子,其原子结构示意图为: ,
,
故答案为:O;Na;Al;S;Cl; ;
;
(2)C为Na、D为Al,金属性越强,最高价氧化物对应水合物的碱性越强,金属性Na>Al,则Na、Al的最高价氧化物对应水化物的碱性强弱顺序为:NaOH>Al(OH)3;
E为S、F为Cl元素,非金属性越强,最高价氧化物对应水合物的酸性越强,非金属性S<Cl,则最高价氧化物对应水化物的酸性强弱顺序为:H2SO4<HClO4,
故答案为:NaOH>Al(OH)3;H2SO4<HClO4;
(3)M为Al(OH)3、N为NaOH,氢氧化铝与氢氧化钠反应生成偏铝酸钠和水,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O;
E的氢化物为H2S,H2S的溶液中通入氯气生成S单质和氯化氢,反应的离子反应方程式为:H2S+Cl2=S↓+2Cl-+2H+,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;H2S+Cl2=S↓+2Cl-+2H+.
点评 本题考查了位置结构与性质的关系及应用,题目难度中等,推断元素为解答关键,明确常见化学用语的书写原则为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案| A. | 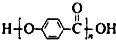 的结构中含有酯基 的结构中含有酯基 | |
| B. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| C. | 1 mol葡萄糖可水解生成2 mol乳酸(C3H6O3) | |
| D. | 纤维素和蔗糖都是能发生水解反应的高分子化合物 |
| A. | 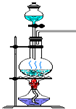 实验室制备氯气 | |
| B. | 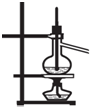 分离沸点相差较大的互溶液体混合物 | |
| C. |  向容量瓶中转移液体 | |
| D. | 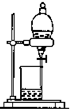 分离互不相溶的两种液体 |
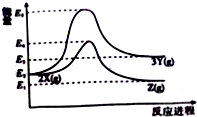
| A. | 由X→Y反应的△H=E5-E2 | |
| B. | 升高温度有利于提高Z的产率 | |
| C. | 由X→Y的反应,增加压强有利于提高X的转化率 | |
| D. | 由X→Z反应的△H<0 |
| A. | 向某溶液中加稀盐酸,将产生的无色气体通入澄清石灰水中,石灰水变浑浊,则原溶液中一定有CO32- | |
| B. | 向某溶液中加入硝酸钡溶液有白色沉淀产生,再加稀盐酸,沉淀不消失,则原溶液中可能含有SO32- | |
| C. | 向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润蓝色石蕊试纸变红,则原溶液中存在NH4+ | |
| D. | 分别含有Mg2+、Cu2+、Fe2+和Na+的四种盐溶液,只用NaOH溶液不能一次鉴别出来 |
| 选项 | 待提纯物质 | 杂质 | 除杂试剂及主要操作方法 |
| A | 苯 | 溴单质 | 加亚硫酸钠溶液洗涤,分液 |
| B | 淀粉胶体 | 葡萄糖 | 水,过滤 |
| C | 甲烷 | 乙烯 | 通入酸性高锰酸钾溶液,洗气 |
| D | 乙酸乙酯 | 乙酸 | 加入氢氧化钠溶液,分液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | CH4与P4的分子结构都是正四面体形,闪此在6.02×1023个CH4分子或P4分子中都含布4×6.02×1023个 共价键 | |
| B. | 在含6.02×1023个硅原子的二氧化硅晶体中含有4×6.02×1023个Si一O键 | |
| C. | 5.6 g Fe与含0.2 mol HNO3的溶液充分反应,至少失去 0.2×6.02×1023个电子 | |
| D. | 6.02×1023个Fe3+完全水解可以得到6.02×1023个氢氧化铁胶体粒子 |







 .
. ;
;