题目内容
(1)①向NaHCO3溶液中,逐滴加入Ca(OH)2溶液至过量,请写出发生反应的离子方程式: .②在Fe(NO3)2溶液中,滴加盐酸,溶液变黄并产生无色气体,请写出反应的离子方程式:
(2)已知:酚酞在c(OH-)为1.0×10-4mol/L~2.5mol/L时呈红色,且0.5min内不会褪色; H2O2具有氧化性和漂白性.
将3.9g过氧化钠放入烧杯中,加入100mLH2O,充分反应后取上述溶液于试管中,滴入2滴酚酞试液,溶液变红,片刻红色褪去.
①有人认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的,试通过估算对比数据判断这种说法是否正确并说明理由.
②还有人认为“红色迅速褪去”是因为溶液中存在H2O2.试设计实验证明烧瓶内的溶液中存在H2O2,请简述实验操作 .
③补充实验,证明“红色迅速褪去”与溶液中存在H2O2有关,请简述实验操作 .
(2)已知:酚酞在c(OH-)为1.0×10-4mol/L~2.5mol/L时呈红色,且0.5min内不会褪色; H2O2具有氧化性和漂白性.
将3.9g过氧化钠放入烧杯中,加入100mLH2O,充分反应后取上述溶液于试管中,滴入2滴酚酞试液,溶液变红,片刻红色褪去.
①有人认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的,试通过估算对比数据判断这种说法是否正确并说明理由.
②还有人认为“红色迅速褪去”是因为溶液中存在H2O2.试设计实验证明烧瓶内的溶液中存在H2O2,请简述实验操作
③补充实验,证明“红色迅速褪去”与溶液中存在H2O2有关,请简述实验操作
考点:离子方程式的书写,过氧化氢,钠的重要化合物,铁盐和亚铁盐的相互转变
专题:离子反应专题,元素及其化合物
分析:(1)NaHCO3溶液加入Ca(OH)2溶液至过量反应生成碳酸钙和氢氧化钠和水;硝酸根在酸性环境下具有强的氧化性,能够氧化二价铁离子;
(2)①依据过氧化钠的量计算出氢氧化钠的物质的量浓度;
②双氧水在二氧化锰催化作用下,分解生成氧气,氧气能够使带火星木条复燃;
③在去除过氧化氢的溶液中再滴加酚酞,如溶液变色,可证明.
(2)①依据过氧化钠的量计算出氢氧化钠的物质的量浓度;
②双氧水在二氧化锰催化作用下,分解生成氧气,氧气能够使带火星木条复燃;
③在去除过氧化氢的溶液中再滴加酚酞,如溶液变色,可证明.
解答:
解:(1)①碳酸氢钠与过量氢氧化钙反应的离子方程式:HCO3-+Ca2++OH-=CaCO3↓+H2O;
②Fe(NO3)2溶液滴加盐酸反应的离子方程式:3Fe2++NO3-+4H+=3Fe3++NO+2H2O;
故答案为:HCO3-+Ca2++OH-=CaCO3↓+H2O;3Fe2++NO3-+4H+=3Fe3++NO+2H2O;
(2)①过氧化钠的物质的量n=
=0.05mol,依据原子个数守恒,Na2O2~2NaOH,所以生成氢氧化钠的物质的量为0.1mol,c(OH-)=
=1mol/L,因为“酚酞在c(OH-)为1.0×10-4mol/L~2.5mol/L时呈红色,且0.5min内不会褪色”,因此,“红色迅速褪去”不是因为溶液中c(OH-)过大造成的,
故答案为:经估算,烧瓶中c(OH-)约为1mol/L;因为“酚酞在c(OH-)为1.0×10-4mol/L~2.5mol/L时呈红色,且0.5min内不会褪色”,因此,“红色迅速褪去”不是因为溶液中c(OH-)过大造成的;
②如存在H2O2,加入二氧化锰,双氧水在二氧化锰催化作用下,分解生成氧气,方法是取烧瓶中的溶液置于试管中,加入少量MnO2.有气泡放出,用带火星的木条检验,木条复燃,说明溶液中可能有H2O2,
故答案为:取烧瓶中的溶液置于试管中,加入少量MnO2.有气泡放出,用带火星的木条检验,木条复燃,说明溶液中可能有H2O2;
③在去除过氧化氢的溶液中再滴加酚酞,如溶液变色,可证明,可取②中试管里的溶液滴加酚酞试液,溶液变红且不褪色,说明“红色迅速褪去”与H2O2的存在有关;
故答案为:取②中试管里的溶液滴加酚酞试液,溶液变红且不褪色,说明“红色迅速褪去”与H2O2的存在有关.
②Fe(NO3)2溶液滴加盐酸反应的离子方程式:3Fe2++NO3-+4H+=3Fe3++NO+2H2O;
故答案为:HCO3-+Ca2++OH-=CaCO3↓+H2O;3Fe2++NO3-+4H+=3Fe3++NO+2H2O;
(2)①过氧化钠的物质的量n=
| 3.9g |
| 78g/mol |
| 0.1mol |
| 0.1L |
故答案为:经估算,烧瓶中c(OH-)约为1mol/L;因为“酚酞在c(OH-)为1.0×10-4mol/L~2.5mol/L时呈红色,且0.5min内不会褪色”,因此,“红色迅速褪去”不是因为溶液中c(OH-)过大造成的;
②如存在H2O2,加入二氧化锰,双氧水在二氧化锰催化作用下,分解生成氧气,方法是取烧瓶中的溶液置于试管中,加入少量MnO2.有气泡放出,用带火星的木条检验,木条复燃,说明溶液中可能有H2O2,
故答案为:取烧瓶中的溶液置于试管中,加入少量MnO2.有气泡放出,用带火星的木条检验,木条复燃,说明溶液中可能有H2O2;
③在去除过氧化氢的溶液中再滴加酚酞,如溶液变色,可证明,可取②中试管里的溶液滴加酚酞试液,溶液变红且不褪色,说明“红色迅速褪去”与H2O2的存在有关;
故答案为:取②中试管里的溶液滴加酚酞试液,溶液变红且不褪色,说明“红色迅速褪去”与H2O2的存在有关.
点评:本题考查了离子方程式的书写、过氧化钠的性质,掌握钠及其化合物的性质,明确过氧化钠与水反应的化学方程式是解题关键,侧重考查学生综合分析问题的能力,题目难度中等.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
为了收集Na与水反应产生的气体,某同学用扎有小孔的铝箔包裹金属钠,放入水中,收集完气体后,取出铝箔,水溶液中含有的溶质可能有( )
| A、NaOH |
| B、Na2O |
| C、NaAlO2 |
| D、Al(OH)3 |
化学上把“生成新物质的变化叫做化学变化”,下面对化学变化中“新物质”的解释,正确的是( )
| A、“新物质”就是自然界中不存在的物质 |
| B、“新物质”就是与变化前的物质在颜色、状态等方面有所不同的物质 |
| C、“新物质”就是与变化前的物质在元素组成上不同的物质 |
| D、“新物质”就是在组成或结构上与变化前的物质不同的物质 |
用下列实验装置完成对应的实验(部分仪器已省略),操作正确并能达到实验目的是( )
A、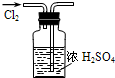 干燥Cl2 |
B、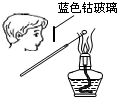 检验K2CO3中的K+ |
C、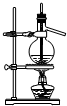 石油的蒸馏 |
D、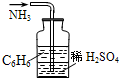 吸收NH3 |
下列离子方程式中,正确的是( )
A、向
| ||||||
| B、向氢氧化钡溶液中逐滴加入硫酸氢钠溶液至恰好不再产生沉淀Ba2++OH-+H++SO42-=BaSO4↓+H2O | ||||||
| C、氯气通入水中Cl2+H2O=2H++ClO-+Cl- | ||||||
| D、向氢氧化钾溶液中滴加少量氢碘酸OH-+HI=I-+H2O |



