题目内容
14.下列关于电解质溶液的叙述正确的是( )| A. | 常温下,在pH=7的醋酸钠和醋酸混合溶液中,c(CH3COO-)>c(Na+) | |
| B. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| C. | 在pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-) | |
| D. | 在0.1 mol•L-1的硫化钠溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) |
分析 A.常温下,pH=7的溶液呈中性,溶液中存在c(OH-)=c(H+),根据电荷守恒判断c(CH3COO-)、c(Na+)相对大小;
B.稀释醋酸时,醋酸中c(OH-)增大;
C.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
D.任何电解质溶液中都存在电荷守恒、物料守恒,根据电荷守恒和物料守恒判断.
解答 解:A.常温下,pH=7的溶液呈中性,溶液中存在c(OH-)=c(H+),根据电荷守恒得c(CH3COO-)=c(Na+),水的电离程度很小,所以离子浓度大小顺序是c(CH3COO-)=c(Na+)>c(OH-)=c(H+),故A错误;
B.稀释醋酸时,增大醋酸电离程度,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(CH3COO-)、c(CH3COOH)、c(H+)都减小,温度不变,离子积常数不变,所以醋酸中c(OH-)增大,故B错误;
C.任何电解质溶液中都存在物料守恒,根据物料守恒得c(Na+)=c(Cl-),故C正确;
D.任何电解质溶液中都存在电荷守恒、物料守恒,根据电荷守恒得c(OH-)+c(HS-)+2c(S2-)=c(H+)+c(Na+),根据物料守恒得c(Na+)=2[c(HS-)+c(H2S)+c(S2-)],所以得c(OH-)=c(H+)+c(HS-)+2c(H2S),故D错误;
故选C.
点评 本题考查离子浓度大小比较,为高频考点,明确溶液中溶质及其性质是解本题关键,任何电解质溶液中都存在电荷守恒和物料守恒,与电解质溶液酸碱性及浓度无关,易错选项是BC,题目难度中等.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
14.在溶液导电性实验中,往氢氧化钡溶液中滴加硫酸至过量,灯泡的明亮度变化是:明→暗→明,下列说法正确的是( )
| A. | 溶液的导电性与溶液中离子的浓度有关 | |
| B. | 溶液的导电性与溶液中离子数目的多少有关 | |
| C. | 灯泡最暗时溶液中无自由移动的离子 | |
| D. | 往氢氧化钡溶液中滴加盐酸与滴加硫酸时现象相同 |
2.某化学兴趣小组欲对含少量硫酸亚铁和硫酸铁的硫酸铜溶液进行综合实验:
(1)除去Fe2+和Fe3+并制备CuSO4•5H2O,请根据以下流程回答问题:
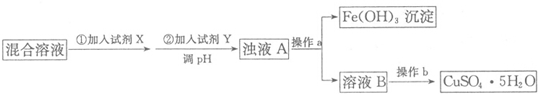
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
①试剂X的化学式为H2O2,加入试剂Y调节溶液pH的范围是3.7-4.7;
②操作a用到的玻璃仪器为烧杯,玻璃棒和漏斗;操作b的名称为蒸发浓缩、冷却结晶;
(2)已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,欲测定混合溶液中的Fe2+的浓度,取待测液20.00mL,用浓度为0.01mol•L-1的酸性KMnO4溶液滴定,下列滴定方式中,最合理的是b(填字母序号,夹持部分已略去)
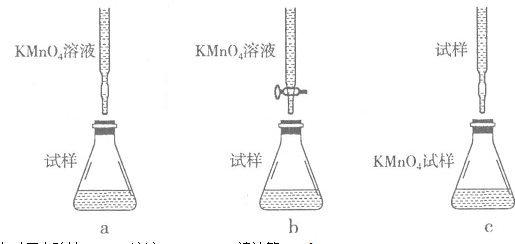
达到终点时用去酸性KMnO4溶液12.00mL,请计算c(Fe2+)=0.03mol/L.
(1)除去Fe2+和Fe3+并制备CuSO4•5H2O,请根据以下流程回答问题:

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.9 | 6.5 | 4.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 6.7 |
②操作a用到的玻璃仪器为烧杯,玻璃棒和漏斗;操作b的名称为蒸发浓缩、冷却结晶;
(2)已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,欲测定混合溶液中的Fe2+的浓度,取待测液20.00mL,用浓度为0.01mol•L-1的酸性KMnO4溶液滴定,下列滴定方式中,最合理的是b(填字母序号,夹持部分已略去)

达到终点时用去酸性KMnO4溶液12.00mL,请计算c(Fe2+)=0.03mol/L.
9.下列说法不正确的是( )
| A. | 物质燃烧总是放热的 | |
| B. | 放热反应在反应发生时都不需要加热 | |
| C. | 热化学方程式中,化学式前的化学计量数仅表示物质的量 | |
| D. | 大多数化合反应是放热的,大多数分解反应是吸热的 |
19.工业上利用Ga与NH3合成氮化镓的反应方程式为:2Ga(s)+2NH3(g)?2GaN(s)+3H2(g)△H<0
在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是( )

在恒温恒容的密闭体系内进行上述可逆反应,下列有关表达正确的是( )

| A. | ①图象中如果纵坐标为正反应速率,则t时刻改变的条件可以为升温或加压 | |
| B. | ②图象中纵坐标可以为镓的转化率 | |
| C. | ③图象中纵坐标可以为化学反应速率 | |
| D. | ④图象中纵坐标可以为体系内混合气体平均相对分子质量 |
6.下列说法正确的是( )
| A. | 有单质生成的分解反应一定是氧化还原反应 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 氧化剂被氧化,还原剂被还原 | |
| D. | 没有氧元素参加的反应一定不是氧化还原反应 |
3.“类推”是一种重要的学习方法,但有时会产生错误结论,下列类推结论中正确的是( )
| A. | 碱金属氟化物的晶格能顺序是LiF>NaF>KF>RbF>CsF;则钠的卤化物的晶格能顺序是NaF>NaCl>NaBr>NaI | |
| B. | ⅣA族元素氢化物沸点顺序是GeH4>SiH4>CH4;则ⅤA族元素氢化物沸点顺序是AsH3>PH3>NH3 | |
| C. | 晶体中有阴离子,必有阳离子;则晶体中有阳离子,必有阴离子 | |
| D. | 若盐酸的浓度是醋酸浓度的2倍;则盐酸中H+浓度也是醋酸中H+浓度的2倍 |
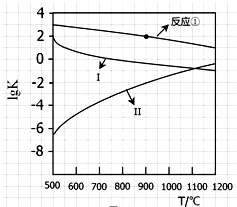 用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应.
用CaSO4代替O2与燃料CO反应,既可提高燃烧效率,又能得到高纯CO2,是一种高效、清洁、经济的新型燃烧技术,反应①为主反应,反应②和③为副反应. .
. 已知水的电离平衡曲线如图所示,试回答下列问题:
已知水的电离平衡曲线如图所示,试回答下列问题: