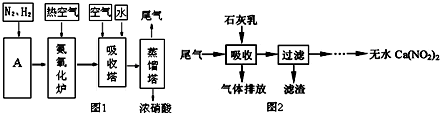
题目内容
8.下列电子式书写正确的是( )| A. | HClO  | B. | OH-  | C. | HCl  | D. | Na2O2  |
分析 A.次氯酸分子的中心原子为O原子,分子中不存在H-Cl键;
B.氢氧根离子为阴离子,电子式中需要标出所带电荷;
C.氯化氢为共价化合物,分子中不存在阴阳离子;
D.过氧化钠为离子化合物,钠离子和过氧根离子需要标出所带电荷,过氧根离子还需要标出最外层电子.
解答 解:A.HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸正确的电子式为 ,故A错误;
,故A错误;
B.氢氧根离子为阴离子,电子式中需要标出电荷及原子的最外层电子,氢氧根离子的电子式为 ,故B错误;
,故B错误;
C.HCl为共价化合物,组成原子最外层满足稳定结构,电子式为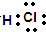 ,故C错误;
,故C错误;
D.过氧化钠属于离子化合物,钠离子直接用离子符号表示,过氧根离子需要标出最外层电子及所带电荷,过氧化钠的电子式为 ,故D正确;
,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度不大,侧重考查电子式的书写,明确电子式的书写原则为解答关键,A为易错点,注意次氯酸的中心原子为氧原子,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
18.下列各组物质中,表中a→b、b→c的相互转化不能一步完成的是( )
| a | b | c | |
| A | SiO2 | Na2SiO3 | H2SiO3 |
| B | NO | NO2 | HNO3 |
| C | Fe | FeCl3 | Fe(OH)3 |
| D | Al(OH)3 | Na[Al(OH)4] | Al2O3 |
| A. | A | B. | B | C. | C | D. | D |
19.甲烷分子中的4个氢原子全部被苯基取代,所得物质的分子结构如图所示,对该物质的描述不正确的是( )
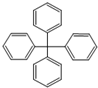

| A. | 其分子式为C25H20 | |
| B. | 分子内的所有碳原子可能共平面 | |
| C. | 完全燃烧生成CO2和H2O的物质的量之比为5:2 | |
| D. | 此分子的一氯代物有三种同分异构体 |
16.交通警察用经硫酸酸化处理的三氧化铬(CrO3)硅胶检查司机呼出的气体,根据硅胶颜色的变化(硅胶中+6价铬能被酒精蒸气还原为+3价铬,颜色由红色变为绿色),可以判断司机是否酒后驾车.下列有关该反应原理的说法中正确的是( )
| A. | 三氧化铬作还原剂 | B. | 乙醇作还原剂 | ||
| C. | CrO3中Cr被氧化 | D. | 乙醇发生还原反应 |
3.下列有关化学用语表示正确的是( )
| A. | 乙酸的结构简式:C2H4O2 | B. | Cl-的结构示意图为 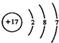 | ||
| C. | 中子数为20 的氯原子:3717Cl | D. | NH3 的电子式: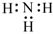 |
13.下列说法正确的是( )
| A. | 将足量的Na2O2和Na2O分别加入酚酞试液中,最终溶液均为红色 | |
| B. | Na3N是离子化合物,溶于水后得到的溶液能使无色酚酞试液变红 | |
| C. | 2Na2O2+2H2O═4NaOH+O2↑,是水作还原剂的氧化还原反应 | |
| D. | 过氧化钠会因为与空气中的氧气反应而易变质 |
20.下列离子组在溶液中能大量共存的是( )
| A. | Fe3+、SO42-、I-、K+ | B. | K+、Al3+、SO42-、MnO4- | ||
| C. | H+、NO3-、Fe2+、Na+ | D. | Ba2+、NH4+、Br-、OH- |
8.下列有关说法正确的是( )
| A. | 加入KSCN溶液,出现红色,一定不含Fe2+ | |
| B. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| C. | SiO2与Al2O3都既可以与酸又可以与碱反应,故都是两性氧化物 | |
| D. | 玻璃、水泥、陶瓷、刚玉都是硅酸盐材料 |