题目内容
3.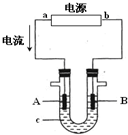 电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:(1)若A、B都是惰性电极,c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,则:B 极(填“A”或“B”)附近先呈红色;电解饱和NaCl溶液的总反应方程式:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
(2)若要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则:
①A电极反应式是Cu-2e-=Cu2+.
②B电极反应式是Cu2++2e-=Cu.
(说明:杂质发生的电极反应不必写出)
③下列说法正确的是bd.
a.电能全部转化为化学能
b.在电解精炼过程中,电解液中伴随有Al3+、Zn2+产生
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
(3)用惰性电极电解CuSO4溶液.若阴极析出Cu的质量为12.8g,则阳极上产生的气体在标准状况下的体积为2.24L.
(4)利用反应2Cu+O2+2H2SO4═2CuSO4+2H2O可制备CuSO4,若将该反应设计为电解池.阴极电极反应式为O2+4H++4e-=2H2O.
分析 (1)根据电流方向知,a是正极,b是负极,电解氯化钠溶液,在阳极上是氯离子失电子的氧化反应,在阴极上是氢离子得电子的还原反应,据此回答;
(2)电解精炼中,粗铜作阳极,纯铜作阴极,根据电解池的工作原理来回答;
a.电能不能全部转化为化学能;
b.在电解精炼过程中,阳极上金属放电;
c.溶液中Cu2+向阴极移动;
d.在阳极的底部可回收不活泼金属;
(3)根据转移电子相等计算;
(4)该反应不能自发进行,所以只能设计成电解池,失电子的金属作阳极,反应方程式中溶液为电解质溶液,阴极上得电子发生还原反应.
解答 解:(1)根据电流方向知,a是正极,A是阳极,b是负极,B是阴极,电解氯化钠溶液,在阳极上是氯离子失电子的氧化反应,产生氯气,在阴极上是氢离子得电子的还原反应,产生氢气,该电极附近产生高浓度的氢氧化钠,遇到酚酞显示红色,电解氯化钠生成氢氧化钠和氢气、氧气,即2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,
故答案为:B;2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑;
(2)①电解精炼中,粗铜作阳极,纯铜作阴极,A是阳极,则A极材料是粗铜,阳极上铜失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+,故答案为:Cu-2e-=Cu2+;
②B是阴极,B材料是粗铜,该极上铜离子得电子生成金属铜,即电极反应式为:Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
③a.电能大多转化为化学能,但是还有热能的产生,故错误;
b.在电解精炼过程中,在阳极上,比金属铜活泼的Al、Zn小于金属铜失电子,所以电解液中伴随有Al3+、Zn2+产生,故正确;
c.溶液中Cu2+向阴极移动,故错误;
d.在阳极上,活泼性较差的Ag、Pt、Au形成阳极泥,利用阳极泥可回收Ag、Pt、Au等金属,故正确.
故选bd;
(3)电解硫酸铜溶液时,阳极上氢氧根离子放电,生成1mol氧气需要4mol电子,根据转移电子相等得阳极上产生的气体在标准状况下的体积=$\frac{\frac{12.6g}{64g/mol}×2}{4}$×22.4L/mol=2.24L,
故答案为:2.24;
(4)该反应不能自发进行,所以只能设计成电解池,失电子的金属作阳极,反应方程式中溶液为电解质溶液,阴极上得电子发生还原反应,所以若将该反应设计为电解池,其电解质溶液需用稀硫酸,阳极材料是用铜,阴极电极反应式为O2+4H++4e-=2H2O,
故答案为:O2+4H++4e-=2H2O.
点评 本题考查了电解原理,正确判断阴阳极是解本题关键,注意电极反应式的书写是关键,难度不大.

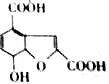
 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示,有关该物质的说法中正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如图所示,有关该物质的说法中正确的是( )| A. | 该物质的分子式为C16H14O3 | |
| B. | 滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 | |
| C. | 1mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4mol和7mol | |
| D. | 该分子中的所有碳原子不可能共平面 |
| A. | M的分子式为C18H8O8 | |
| B. | 1molM最多可与3molNa反应 | |
| C. | 一个M分子中含有一个苯环和两个羧基 | |
| D. | M可发生酯化反应,氧化反应 |
| A. | 锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 | |
| D. | 盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次 |
| A. | Q2=$\frac{1}{2}$ Q1=98.5 | B. | Q2=$\frac{1}{2}$ Q1<98.5 | C. | Q2<$\frac{1}{2}$ Q1<98.5 | D. | $\frac{1}{2}$Q1<Q2<98.5 |
| A. |  | B. |  | C. |  | D. |  |