题目内容
下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
| 选项 | 离子组 | 加入或通入的试剂 | 发生反应的离子方程式 |
| A | NH4+、Fe3+、SO42- | 少量Ba(OH)2溶液 | 2NH4++SO42-+Ba2++2OH-=BaSO4↓+2NH3?H2O |
| B | Na+、HCO3-、Cl- | 少量石灰乳 | Ca2++2OH-+2HCO3-=2H2O+CaCO3↓+CO32- |
| C | K+、OH-、CO32- | 少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe2+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO3↑+H2O |
| A、A | B、B | C、C | D、D |
考点:离子共存问题,离子方程式的书写
专题:
分析:根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应等,则离子大量共存,且加入试剂符合反应的先后顺序,以此来解答.
解答:
解:A.该组离子之间不反应,可大量共存,且加入少量Ba(OH)2溶液,发生Fe2++SO42-+Ba2++2OH-=BaSO4↓+Fe(OH)2,故A错误;
B.该组离子之间不反应,可大量共存,且加入少量石灰乳,发生Ca(OH)2+2HCO3-=2H2O+CaCO3↓+CO32-,故B错误;
C.该组离子之间不反应,可大量共存,且加入少量CO2,发生2OH-+CO2=CO32-+H2O,故C正确;
D.Fe2+、NO3-、HSO3-发生氧化还原反应,不能大量共存,故D错误;
故选C.
B.该组离子之间不反应,可大量共存,且加入少量石灰乳,发生Ca(OH)2+2HCO3-=2H2O+CaCO3↓+CO32-,故B错误;
C.该组离子之间不反应,可大量共存,且加入少量CO2,发生2OH-+CO2=CO32-+H2O,故C正确;
D.Fe2+、NO3-、HSO3-发生氧化还原反应,不能大量共存,故D错误;
故选C.
点评:本题考查离子共存及离子反应,为高频考点,把握常见离子之间的反应及与量有关的离子反应为解答的关键,侧重分析与应用能力的综合考查,注意石灰乳在离子反应中保留化学式,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为a(不考虑硝基与氢氧化钠的反应),则a是( )
已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如图:1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为a(不考虑硝基与氢氧化钠的反应),则a是( )| A、5mol | B、6mol |
| C、7mol | D、8mol |
大理石是一种重要的化工原料,其主要成分可以反应生成一系列物质,如下图所示.
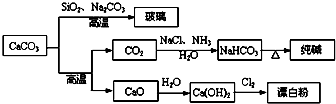
下列说法正确的是( )

下列说法正确的是( )
| A、Cl2和SO2均可以漂白有色物质,且漂白的原理相同 | ||||
B、由SiO2+Na2CO3
| ||||
| C、向饱和碳酸钠溶液中通入过量CO2,溶液变浑浊 | ||||
| D、制取玻璃和漂白粉所涉及的反应都是非氧化还原反应 |
天然气和液化石油气(主要成分为C3~C5的烷烃)燃烧的化学方程式分别为:CH4+2O2
CO2+2H2O,C3H8+5O2
CO2+4H2O,现有一套以天然气为燃料的灶具,今改用液化石油气,应采取的正确措施是( )
| 点燃 |
| 点燃 |
| A、增大空气进入量或减小石油气进入量 |
| B、增大空气进入量或增大石油气进入量 |
| C、减小空气进入量或减小石油气进入量 |
| D、减小空气进入量或增大石油气进入量 |
下列常见的反应,在理论上不能用于设计原电池的是( )
| A、H2SO4(aq)+BaCI2(aq)═2HCl(aq)+BaSO4(s) |
| B、CH3CH2OH(l)+3O2(g)═2CO2(g)+3H2O(l) |
| C、4Fe(OH)2(S)+2H2O(l)+O2(g)═4Fe(OH)3 |
| D、2H2(g)+O2(g)═2H2O(l) |
下列变化中,不需要破坏化学键的是( )
| A、加热氯化铵使其分解 |
| B、氯化钠晶体熔化 |
| C、干冰气化 |
| D、氯化氢溶于水 |
下列物质中含有非极性共价键的离子化合物是( )
| A、Ba(OH)2 |
| B、CaCl2 |
| C、H2O |
| D、Na2O2 |
下列微粒中,中子数和质子数相等的是( )
①18O;②12C;③26Mg;④40K;⑤40Ca.
①18O;②12C;③26Mg;④40K;⑤40Ca.
| A、①② | B、②⑤ | C、只有④ | D、③④ |
重水( 21D2O)是重要的核工业原料,下列说法错误的是( )
| A、氘(D)原子核外有1个电子 |
| B、1H与D互称同位素 |
| C、H2O与D2O互称同素异形体 |
| D、1H218O与D216O的相对分子质量相同 |