题目内容
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO?Cr2O3,杂质为SiO2、Al2O3)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图.涉及的主要反应是:
6FeO?Cr2O3+24NaOH+7KClO3═12Na2CrO4+3Fe2O3+7KCl+12H2O
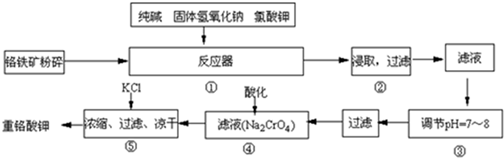
(1)碱浸前将铬铁矿粉碎的目的是 .
(2)步骤③调节pH后过滤得渣是 .
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式 .
(4)用简要的文字说明操作⑤加入KC1的原因
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法.该法是向废水中加入FeSO4?7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[Fe
Cr
]O4(铁氧磁体,罗马数字表示元素价态)的沉淀.处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是 .Ⅲ
A.x=0.5,a=8 B.x=0.5,a=10 C.x=1.5,a=8 D.x=1.5,a=10.
6FeO?Cr2O3+24NaOH+7KClO3═12Na2CrO4+3Fe2O3+7KCl+12H2O

(1)碱浸前将铬铁矿粉碎的目的是
(2)步骤③调节pH后过滤得渣是
(3)操作④中,酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式
(4)用简要的文字说明操作⑤加入KC1的原因
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法.该法是向废水中加入FeSO4?7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[Fe
Ⅲ x |
Ⅲ (2-x) |
A.x=0.5,a=8 B.x=0.5,a=10 C.x=1.5,a=8 D.x=1.5,a=10.
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:工业上常用铬铁矿(主要成分为FeO?Cr2O3,杂质为SiO2、Al2O3)为原料生产重铬酸钾:在反应器①中,6FeO?Cr2O3+24NaOH+7KClO3═12Na2CrO4+3Fe2O3+7KCl+12H2O,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,NaFeO2能强烈水解,为强碱弱酸液,水解呈碱性,生成氢氧化铁沉淀,反应的离子方程式为FeO2-+2H2O=Fe(OH)3↓+OH-,由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O?HSiO3-+OH-、HSiO3-+H2O?H2SiO3+OH-、AlO2-+2H2O?Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,操作④中酸化时,CrO42-转化为Cr2O72-,常温下重铬酸钾的溶解度较小,操作⑤中利用Na2Cr2O7+2KCl═K2Cr2O7+2NaCl复分解反应,得到重铬酸钾.
(1)依据影响化学反应速率的因素分析,增大接触面积会加快反应速率;
(2)根据水解平衡移动判断产物;
(3)在酸性环境下,CrO42-转化为Cr2O72-,据此来书写方程式;
(4)操作⑤加入KCl的原因温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大;
(5)根据氧化还原反应中得失电子数相等,再结合原子守恒进行计算.
(1)依据影响化学反应速率的因素分析,增大接触面积会加快反应速率;
(2)根据水解平衡移动判断产物;
(3)在酸性环境下,CrO42-转化为Cr2O72-,据此来书写方程式;
(4)操作⑤加入KCl的原因温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大;
(5)根据氧化还原反应中得失电子数相等,再结合原子守恒进行计算.
解答:
解:工业上常用铬铁矿(主要成分为FeO?Cr2O3,杂质为SiO2、Al2O3)为原料生产重铬酸钾:在反应器①中,6FeO?Cr2O3+24NaOH+7KClO3═12Na2CrO4+3Fe2O3+7KCl+12H2O,有Na2CrO4生成,同时Fe2O3转变为NaFeO2,杂质SiO2、Al2O3与纯碱反应转变为可溶性盐,NaFeO2能强烈水解,为强碱弱酸液,水解呈碱性,生成氢氧化铁沉淀,反应的离子方程式为FeO2-+2H2O=Fe(OH)3↓+OH-,由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O?HSiO3-+OH-、HSiO3-+H2O?H2SiO3+OH-、AlO2-+2H2O?Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,操作④中酸化时,CrO42-转化为Cr2O72-,常温下重铬酸钾的溶解度较小,操作⑤中利用Na2Cr2O7+2KCl═K2Cr2O7+2NaCl复分解反应,得到重铬酸钾.
(1)增大接触面积会加快反应速率,碱浸前将铭铁矿粉碎的作用是增大接触面积加快反应速率,
故答案为:增大接触面积,增大反应速率;
(2)由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O?HSiO3-+OH-、HSiO3-+H2O?H2SiO3+OH-、AlO2-+2H2O?Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,
故答案为:H2SiO3、Al(OH)3;
(3)在酸性环境下,CrO42-转化为Cr2O72-,即2CrO42-+2H+?Cr2O72-+H2O;
故答案为:2CrO42-+2H+?Cr2O72-+H2O;
(4)操作⑤加入KCl的原因是:温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用Na2Cr2O7+2KCl═K2Cr2O7+2NaCl复分解反应,将溶液浓缩后,冷却,即有大量重铬酸钾结晶析出,氯化钠仍留在溶液中,可得到重铬酸钾,
故答案为:温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应,可得到重铬酸钾;
(5)处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,根据铬原子守恒得,1mol Cr2O72-完全反应后生成
molFeⅡ[FeⅢx?CrⅢ2-x]O4,根据铁原子守恒得amol=
mol①,
该反应中得失电子数相等,1mol×2×3=
mol×(3-2)×x,解得x=1.5,将x=1.5代入①得a=10,
故答案为:D.
(1)增大接触面积会加快反应速率,碱浸前将铭铁矿粉碎的作用是增大接触面积加快反应速率,
故答案为:增大接触面积,增大反应速率;
(2)由于硅酸钠和偏铝酸钠在溶液中发生水解,SiO32-+H2O?HSiO3-+OH-、HSiO3-+H2O?H2SiO3+OH-、AlO2-+2H2O?Al(OH)3+OH-,降低pH有利于水解平衡向正反应方向移动,当pH调到7~8时能使它们完全水解生成沉淀,
故答案为:H2SiO3、Al(OH)3;
(3)在酸性环境下,CrO42-转化为Cr2O72-,即2CrO42-+2H+?Cr2O72-+H2O;
故答案为:2CrO42-+2H+?Cr2O72-+H2O;
(4)操作⑤加入KCl的原因是:温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用Na2Cr2O7+2KCl═K2Cr2O7+2NaCl复分解反应,将溶液浓缩后,冷却,即有大量重铬酸钾结晶析出,氯化钠仍留在溶液中,可得到重铬酸钾,
故答案为:温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,利用复分解反应,可得到重铬酸钾;
(5)处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,根据铬原子守恒得,1mol Cr2O72-完全反应后生成
| 2 |
| 2-x |
| 2(1+x) |
| 2-x |
该反应中得失电子数相等,1mol×2×3=
| 2 |
| 2-x |
故答案为:D.
点评:本题考查较为综合,涉及氧化还原反应、溶解平衡等问题,理解工艺流程以及根据转移电子数相等及原子守恒来分析解答是关键,需要学生具有阅读题目获取信息能力和灵活运用基础知识分析问题、解决问题能力,题目难度中等.

练习册系列答案
相关题目
下列关于有机化合物的叙述中正确的是( )
| A、糖类、蛋白质是高分子化合物,适当的条件下可以发生水解反应 |
| B、甲烷和氯气光照条件下发生取代反应,产物是气体与液体混合物 |
| C、纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 |
| D、乙醇与乙酸不能混合,因为二者可以马上生成乙酸乙酯 |
已知2SO2(g)+O2(g)?2SO3 (g);△H=-197kJ?mol-1.向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3.恒温、恒容下反应达平衡时,下列关系一定正确的是( )
| A、容器内压强P:P甲=P丙<2P乙 |
| B、SO3的质量m:m甲=m丙>2m乙 |
| C、c(SO2)与c(O2)之比k:k甲=k丙>k乙 |
| D、反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙 |
 100mL CaCl2和HCl的混合溶液中加入Na2CO3溶液时,测得生成的沉淀(纵)和所加入Na2CO3溶液的体积(横)的曲线如图所示,若CaCl2的浓度为0.2mol/L,计算原溶液中盐酸的物质的量浓度.
100mL CaCl2和HCl的混合溶液中加入Na2CO3溶液时,测得生成的沉淀(纵)和所加入Na2CO3溶液的体积(横)的曲线如图所示,若CaCl2的浓度为0.2mol/L,计算原溶液中盐酸的物质的量浓度.
