题目内容
下列实验操作中不正确的是( )
| A、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| B、蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 |
| C、蒸发结晶时当蒸发到剩有少量液体时,停止加热,利用余热将液体蒸干 |
| D、用容量瓶配制一定物质的量浓度的NaOH溶液时,溶解后的溶液要马上转移至容量瓶 |
考点:分液和萃取,蒸发和结晶、重结晶,蒸馏与分馏,配制一定物质的量浓度的溶液
专题:化学实验基本操作
分析:A.分液操作时下层液体从下口放出,上层液体从上口倒出;
B.蒸馏时,温度的目的是用来测量馏分的温度;
C.蒸发操作时,应防止温度过高而导致溶质分解;
D.热溶液的体积偏大,影响浓度;
B.蒸馏时,温度的目的是用来测量馏分的温度;
C.蒸发操作时,应防止温度过高而导致溶质分解;
D.热溶液的体积偏大,影响浓度;
解答:
解:A.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,避免两种液体相互污染,故A正确;
B.蒸馏时,温度的目的是用来测量馏分的温度,应位于蒸馏烧瓶的支管口附近,故B正确;
C.蒸发操作时,应防止温度过高而导致溶质分解,应使混合物中剩有少量水份时即停止加热,用余热蒸干,故C正确;
D.用容量瓶配制一定物质的量浓度的NaOH溶液时,溶解后的溶液要冷却至室温后,转移至容量瓶,否则浓度偏大,故D错误;
故选D.
B.蒸馏时,温度的目的是用来测量馏分的温度,应位于蒸馏烧瓶的支管口附近,故B正确;
C.蒸发操作时,应防止温度过高而导致溶质分解,应使混合物中剩有少量水份时即停止加热,用余热蒸干,故C正确;
D.用容量瓶配制一定物质的量浓度的NaOH溶液时,溶解后的溶液要冷却至室温后,转移至容量瓶,否则浓度偏大,故D错误;
故选D.
点评:本题考查化学实验方案的评价,侧重于学生的分析能力和实验能力的考查,注意把握实验的操作的方法和步骤,难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
将一小块钠投入MgCl2溶液中,下列对有关实验结果的预测正确的是( )
| A、钠溶解,底部有银白色金属析出,并且有气体产生 |
| B、只有气体产生 |
| C、只有沉淀产生 |
| D、既有沉淀产生,又有气体产生 |
等体积的硫酸钠、硫酸镁、硫酸铝溶液分别于足量氯化钡溶液反应,若生成硫酸钡的质量相等,则三种硫酸盐的物质的量浓度之比为( )
| A、3:3:1 |
| B、6:3:2 |
| C、3:2:1 |
| D、1:1:1 |
下列实验操作中,错误的是( )
| A、分液时,分液漏斗中下层液体从下口放出后,换个洁净的烧杯,将上层液体从上口放入烧杯中 |
| B、蒸馏时,应使温度计水银球位于蒸馏烧瓶支管口处 |
| C、用酒精萃取溴水溶液中的溴 |
| D、称量时,将称量物体放在称量纸或烧杯中,置于托盘天平的左盘,砝码放在托盘天平的右盘 |
常温下,某无色溶液中由水电离产生的c(H+)=10-12mol/L,则此溶液中一定能大量共存的离子组是( )
| A、Mg2+、NH4+、K+、SO42- |
| B、Na+、S2O32-、OH-、Br- |
| C、Na+、K+、NO3-、SO42- |
| D、K+、Cr2O72-、NO3-、Cl- |
已知还原性S2->I->Fe2+>Br->Cl-,下列判断不正确的是( )
| A、Fe3+与I-在水溶液中不能大量共存 |
| B、氧化性:Cl2>Br2>I2 |
| C、将足量Br2加入到FeCl2溶液中,离子反应方程式为Br2+2Cl-═2Br-+Cl2 |
| D、将Cl2通入到FeBr2溶液中,Cl2应优先氧化Fe2+,再氧化Br- |
下列实验装置或操作能达到实验目的是( )
A、 实验室制硝基苯 |
B、 检查装置气密性 |
C、 利用排空气法收集丙烷 |
D、 石油分馏 |
下列各组离子中,因发生氧化还原反应而不能大量共存的是( )
| A、K+、H+、I-、MnO4- |
| B、Fe3+、Fe2+、SO42-、NO3- |
| C、Al3+、Na+、SO42-、CO32- |
| D、Fe3+、H+、SO42-、ClO- |
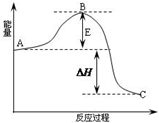 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题: