题目内容
17.0.8mol/L某金属阳离子An+的溶液10mL,恰好将30mL 0.4mol/L的某碳酸钠溶液中的CO32-全部沉淀,则n值是( )| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
分析 根据CO32-与An+离子反应时,恰好将溶液中的An+离子完全沉淀为碳酸盐,利用化合价得出An+离子与CO32-离子的关系,然后利用物质的量来计算解答.
解答 解:溶液中CO32-离子的物质的量为:30mL×10-3×0.4mol•L-1=12×10-3 mol,
溶液中An+离子的物质的量为:10mL×10-3×0.8mol•L-1=8×10-3mol,
由反应中恰好将溶液中的Mn+离子完全沉淀为碳酸盐,设M的化合价为+n,
则SO42-与Rn+反应对应的关系式为:
2Rn+~~~~~n SO42-
2 n
8×10-3mol 12×10-3mol
解得n=$\frac{2×12×1{0}^{-3}mol}{8×1{0}^{-3}mol}$=3,
故选:C.
点评 本题考查学生利用溶液中的离子之间的反应来进行简单计算,明确离子之间的关系是解答的关键,并应熟悉离子的物质的量的计算来解答即可,题目难度中等.

练习册系列答案
相关题目
7.生产铅蓄电池时,在两极板上的铅、锑合金棚架上均匀涂上膏状的PbSO4,干燥后再安装,充电后即可使用,发生的反应:2PbSO4+2H2O$?_{放电}^{充电}$PbO2+Pb+2H2SO4.下列对铅蓄电池的说法错误的是( )
| A. | 需要定期补充硫酸 | |
| B. | 放电时Pb作负极,PbO2作正极 | |
| C. | 放电时负极上发生的反应是Pb+SO42--2e-═PbSO4 | |
| D. | 放电时电解质溶液的密度减小 |
12.下列说法正确的是( )
| A. | 食用冰糖和植物油的主要成分分别是蔗糖和甘油 | |
| B. | 纤维素和光导纤维都属于高分子化合物 | |
| C. | 苯与液溴反应、苯与氢气反应属于同一类型的反应 | |
| D. | 鉴别甲烷和乙烯,可用酸性高锰酸钾溶液或溴的四氯化碳溶液 |
9.吸烟对人体有害,烟草不完全燃烧产生的CO被吸进肺里跟血液中的血红蛋白(用Hb表示)化合,发生下述反应:CO+Hb•O2?O2 +Hb•CO,实验表明,Hb•CO的浓度即使只有Hb•O2的2%时候也足以使人的智力受损.某人吸烟后,在肺部的空气中测得的CO和O2的浓度分别为10-6mol/L和10-2mol/L.已知37℃时,平衡常数K=220,下列说法正确的是( )
| A. | 若加大吸入氧气量,逆反应速率加快,正反应速率减慢 | |
| B. | 若加大吸入氧气量,可改变K值 | |
| C. | 该人血液中Hb•CO浓度在正常范围内,故其智力不会受到损害 | |
| D. | 对于煤气中毒者应立即转移至空气流通处 |



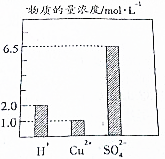 在0.2L由H2SO4、CuSO4和Al2(SO4)组成的混合液中,部分离子浓度大小如图所示,回答下列问题:
在0.2L由H2SO4、CuSO4和Al2(SO4)组成的混合液中,部分离子浓度大小如图所示,回答下列问题: