题目内容
1.明星药物青蒿素的分子式为C15H22O5,键线式为 .关于它的说法中,正确的是( )
.关于它的说法中,正确的是( )| A. | 青蒿素是一种氧化物 | |
| B. | 青蒿素中氧元素的质量分数为11.9% | |
| C. | 青蒿素中C、H、O三种元素的质量比为90:11:40 | |
| D. | 青蒿素是由15个碳原子、22个氢原子和5个氧原子构成的 |
分析 A.根据氧化物的特点考虑;
B.根据氧元素质量分数计算;
C.根据分子式计算;
D.根据结构简式判断分子式,可确定原子个数的比值.
解答 解:A、根据氧化物的概念可知氧化物只有两种元素,且必须有氧元素.该物质由三种元素组成,故A错误;
B、青蒿素中氧元素的质量分数为:$\frac{16×5}{12×15+1×22+16×5}$×100%=28.4%,故B错误;
C、青蒿素中C、H、0三种元素的质量比为12×15:1×22:16×5=90:11:40,故C正确;
D、青蒿素属于物质属于宏观概念可以用元素解释:青蒿素是由碳、氢、氧三种元素组成,故D错误.
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,注意把握有机物的组成,难度不大.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
5.设NA表示阿伏伽德罗常数的值,下列判断正确的是( )
| A. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA | |
| B. | 标准状况下,22.4 L甲醇中含有的C-H的数目为3NA | |
| C. | 25℃时,pH=2的硫酸溶液中,含有的H+的数目为0.01NA | |
| D. | 5.6 g Fe与一定量稀硝酸反应,Fe完全溶解时失去的电子数为3NA |
12.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 使酚酞变红的溶液中:Mg2+、Al3+、NO3-、ClO- | |
| B. | 与Al反应能放H2的溶液中:Na+、Cu2+、NO3-、I- | |
| C. | 0.1 mol•L-1Na2CO3溶液中:NH4+、K+、SO42-、Cl- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1012的溶液中:Ca2+、Na+、SiO32-、HCO3- |
16.下列说法不正确的是( )
①质子数相同的粒子一定属于同种元素;②同位素的性质几乎完全相同;③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;④电子数相同的粒子不一定是同一种元素;⑤一种元素只能有一种质量数:⑥某种元素的相对原子质量取整数,就是其质量数.⑦Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
①质子数相同的粒子一定属于同种元素;②同位素的性质几乎完全相同;③质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;④电子数相同的粒子不一定是同一种元素;⑤一种元素只能有一种质量数:⑥某种元素的相对原子质量取整数,就是其质量数.⑦Cl2中35Cl与37Cl的原子个数之比与HCl中的35Cl与37Cl的原子个数之比相等.
| A. | ②③⑤⑥⑦ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ③④⑥⑦ |
13.苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式为 .下列关于苯佐卡因的叙述正确的是( )
.下列关于苯佐卡因的叙述正确的是( )
 .下列关于苯佐卡因的叙述正确的是( )
.下列关于苯佐卡因的叙述正确的是( )| A. | 分子式为C9H10NO2 | |
| B. | 苯环上有2个取代基,且含有硝基的同分异构体有6种 | |
| C. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| D. | 分子中含有3种官能团 |
10. 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:Mg>Al>Na(用相应的元素符号表示).A、D两种元素中,电负性A>D (填“>”或“<”)
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,C7H15OH 中采用sp3杂化的原子共有8个;
(4)【E(NH3)4】2+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若【E(NH3)4】2+具有对称的空间构型.且当【E(NH3)4】2+中的两个NH3分子被两个Cl-取代时.能得到两种不同结构的产物,则【E(NH3)4】2+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3(1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式${N_A}=\frac{{\sqrt{2}×{{10}^{30}}M}}{{8{r^3}ρ}}$.(用M、r、ρ表示)
 现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.
现有五种元素,其中A、B、C、D、E为原子序数依次增大,且原子序数都不超过36.请根据下列相关信息,回答问题.| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多的 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
(2)A3分子的空间构型为V形,与其互为等电子体的分子为SO2;
(3)解释在水中的溶解度C7H15OH比乙醇低的原因是:乙醇中的羟基与水的羟基结构相似所以溶解度大,C7H15OH中烃基大,与水的羟基结构相似程度小所以溶解度小,C7H15OH 中采用sp3杂化的原子共有8个;
(4)【E(NH3)4】2+配离子中存在的化学键类型有①③(填序号):
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若【E(NH3)4】2+具有对称的空间构型.且当【E(NH3)4】2+中的两个NH3分子被两个Cl-取代时.能得到两种不同结构的产物,则【E(NH3)4】2+的空间构型为a(填序号).
a.平面正方形b.正四面体 c.三角锥形 d.V形
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为r pm,密度为ρg/cm3(1pm=10-10cm)那么写出阿伏伽德罗常数NA的表达式${N_A}=\frac{{\sqrt{2}×{{10}^{30}}M}}{{8{r^3}ρ}}$.(用M、r、ρ表示)

 .
. A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):
A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):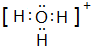 .
.