题目内容
【题目】镓(31Ga)是化学史上第一个先从理论上被预言,后在自然界被发现的元素。Ga与K同周期。下列说法不正确的是
A.Ga在周期表中的位置:第四周期第ⅢA族
B.原子半径:Ga > K
C.中子数为36的Ga的核素:![]()
D.最高价氧化物对应水化物的碱性:Ga(OH)3>Al(OH)3
【答案】B
【解析】
A.Ga与Al同主族,与K同周期,在周期表中的位置:第四周期第ⅢA族,A项正确;
B.同一周期,原子半径从左至右,逐渐减小,因此K的原子半径更大,B项错误;
C.Ga元素原子序数为31,因此中子数为36的核素,质量数为67,C项正确;
D.同一主族,从上至下,元素的金属性增强,最高价氧化物对应水化物的碱性也增强,因此,Ga(OH)3碱性强于Al(OH)3,D项正确;
答案选B。

【题目】学习小组探究AgNO3、Ag2O(棕黑色固体,难溶于水)对氯水漂白性的影响。
实验记录如下:
| 实验 | 方案和现象 |
ⅰ | 加入1mL蒸馏水,再滴加1滴品红溶液,品红溶液较快褪色 | |
ⅱ | 加入少量Ag2O固体,产生白色沉淀a。再加入1mL蒸馏水和 1滴品红溶液,品红溶液褪色比i快 | |
ⅲ | 加入1mL较浓AgNO3溶液,产生白色沉淀b。再滴加1滴品红溶液,品红溶液褪色比i慢 |
(1)用离子方程式表示i中品红溶液褪色的原因:______。
(2)经检验,ii中的白色沉淀a是AgCl。产生AgCl的化学方程式是_______。
(3)ⅰ是iii的对比实验,目的是排除iii中______造成的影响。
(4)研究白色沉淀b的成分。进行实验iv(按实验iii的方案再次得到白色沉淀b,过滤、洗涤,置于试管中):
实验iv:
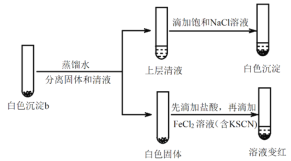
①设计对比实验证实白色沉淀b不只含有AgCl,实验方案和现象是_______。
②FeCl2溶液的作用是_______。由此判断,白色沉淀b可能含有AgClO。
(5)进一步研究白色沉淀b和实验iii品红溶液褪色慢的原因,进行实验v:
实验v:

①结合离子方程式解释加入饱和NaCl溶液的目的:_______。
②推测品红溶液褪色的速率:实验iii比实验v______(填“快”或 “慢”)。