题目内容
13.(1)原子核内有10个质子的原子是Ne;核外有10个电子的二价阳离子Mg2+;核外有18个电子的一价阴离子Cl-.(填微粒符号)(2)在下列原子(或离子)结构简图上表示的微粒中(用元素符号填空)

半径最小的是F只有还原性的是S2-、Na;
只有氧化性的是F,得失电子能力均最弱的是C.
分析 (1)原子核内有10个质子的原子为氖原子;核外有10个电子的二价阳离子,其核内质子数为10+2=12,所以为镁离子;核外有18个电子的一价阴离子,该元素的核电荷数为18-1=17,为氯离子;
(2)由原子(或离子)结构简图可知A、B、C、D分别为Na、C、S2-、F;
电子层越多,半径越大;电子层数相同,原子序数越小,半径越大;
由元素的化合价可知,微粒中元素的化合价处于最低价具有还原性,处于最高价具有氧化性,处于中间价态时既有氧化性又有还原性;
最外层电子数为4时,既不容易得到电子,也不容易失去电子;
解答 解:(1)原子核内有10个质子的原子为氖原子(Ne);
核外有10个电子的二价阳离子,则其核电荷数为:10+2=12,该阳离子为镁离子(Mg2+);
核外有18个电子的一价阴离子,其核电荷数=18-1=17,该粒子为氯离子(Cl-);
故答案为:Ne;Mg2+;Cl-;
(2)由原子(或离子)结构简图可知A、B、C、D分别为:Na、C、S2-、F;
电子层越多,半径越大;电子层数相同,原子序数越小,半径越大,所以原子半径最小的是F;
F为元素的最低价,只具有氧化性,S2-、Na为元素的最低价,只具有还原性,C为元素的中间价态,既有氧化性又有还原性;
碳原子最外层电子数为4,既不容易得到电子,也不容易失去电子;
故答案为:F;S2-、Na;F;C.
点评 本题考查原子或离子结构、氧化还原反应,注意元素的价态及元素性质的关系即可解答,题目难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
20.下列说法中不正确的是( )
| A. | 宇宙星体、地球内部都处于高压状态,探究“高压下钠和锂单质金属→绝缘体转变”现象的本质、理解处于高压状态下一些物质的行为具有重要意义,它们可以为研究星体和地球内部构造提供理论支持 | |
| B. | 工业、农业以及日常生活中产生的污水应当分开处理.常用的污水处理方法有中和法、氧化还原法、离子交换法、萃取法、吹脱法、吸附法、电渗析法等,其中前三种属于化学处理方法 | |
| C. | 新型炸药--C4塑胶炸药得名于其空间网状延展结构的每个结构基元含有4个碳原子,由于该炸药成体时无需包裹金属外壳及添加金属芯件,因此能轻易躲过普通X光安全检查,具有较强的隐蔽性 | |
| D. | 建筑领域常使用的黏土、石英、白垩石和多用于农业和食品工业的硅藻土、硅胶均不属于硅酸盐材料的范畴 |
1.烷烃的系统命名法是我国化学学会根据IUPAC并结合我国汉字使用习惯而制定的,其规定必然遵循我们的认知习惯.包括从选主链定“主基调”,给支键编号定坐标,不同基,从简到繁等.这样易辨易写,边读边辨. 在系统命名法中,下列碳原子主链名称不是丁烷的是( )
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)3CCH2CH3 |
8.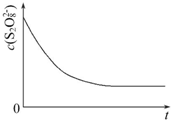 碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O82-+2I-═2SO42-+I2(慢) I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<2.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
表中Vx2.0 mL,理由是保证反应物K2S2O8浓度改变,而其他的条件不变,才能达到实验目的.
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s)═2LiI(s)△H
已知:①4Li(s)+O2(g)═2Li2O(s)△H1
②4LiI(s)+O2(g)═2I2(s)+2Li2O(s)△H2
则电池反应的△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$;碘电极作为该电池的正极.
 碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:S2O82-+2I-═2SO42-+I2(慢) I2+2S2O32-═2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<2.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s)═2LiI(s)△H
已知:①4Li(s)+O2(g)═2Li2O(s)△H1
②4LiI(s)+O2(g)═2I2(s)+2Li2O(s)△H2
则电池反应的△H=$\frac{△{H}_{1}-△{H}_{2}}{2}$;碘电极作为该电池的正极.
5.可将AgNO3溶液、NaOH溶液、KSCN溶液、石碳酸、碳酸氢钠、稀HCl溶液区分开来的一种试剂是( )
| A. | AlCl3 | B. | FeCl3 | C. | FeCl2 | D. | MgCl2 |
2.下列实验所用实验药品和实验器材,与相应实验一致的是( )
| 实验 | 实验药品 | 实验器材(省略加持装置) | |
| A | 制备氧气 | 双氧水、二氧化锰 | 分液漏斗、烧瓶、酒精灯、导管 |
| B | 除去CO2中的HCl气体 | 饱和Na2CO3溶液 | 洗气瓶、导管 |
| C | 配制0.5mol/L、230mL的稀硫酸溶液 | 用98%、1.84g/mL的浓硫酸6.8ml | 10mL量筒、烧杯、玻璃棒、胶头滴管、250容量瓶 |
| D | 检验碳与浓硫酸加热产生的气体中是否含有CO2 | 澄清石灰水 | 烧杯、导管 |
| A. | A | B. | B | C. | C | D. | D |
3.甲苯( )分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
)分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
 )分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )
)分子中苯环上的一个氢被-C4H9原子团取代形成的有机物共有( )| A. | 8种 | B. | 12种 | C. | 10种 | D. | 16种 |
 现有反应:A.CaCO3═CaO+CO2
现有反应:A.CaCO3═CaO+CO2 