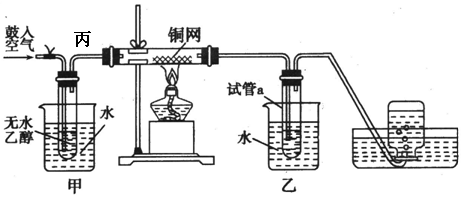
题目内容
18.将100mL 1.0mol/L AlCl3溶液取出10mL,与这10mL溶液中Cl-物质的量浓度相等的是( )| A. | 30mL 1.0mol/L NaCl溶液 | B. | 10mL2.0mol/L FeCl3溶液 | ||
| C. | 50mL1.5mol/L MgCl2溶液 | D. | 100mL1.0mol/L HCl溶液 |
分析 1.0mol/L AlCl3溶液中Cl-物质的量浓度为1.0mol/L×3=3mol/L,结合选项中溶质的浓度及构成计算离子的浓度,以此来解答.
解答 解:A.1.0mol/L NaCl溶液中Cl-物质的量浓度为1.0mol/L,故A不选;
B.2.0mol/L FeCl3溶液中Cl-物质的量浓度为2.0mol/L×3=6mol/L,故B不选;
C.1.5mol/L MgCl2溶液中Cl-物质的量浓度为1.5mol/L×2=3mol/L,故C选;
D.1.0mol/L HCl溶液中Cl-物质的量浓度为1.0mol/L,故D不选;
故选C.
点评 本题考查物质的量浓度的计算,为高频考点,把握溶质浓度与离子浓度的关系为解答该题的关键,侧重分析与计算能力的考查,注意物质的构成及电离,题目难度不大.

练习册系列答案
相关题目
19.下列变化属于物理变化的是( )
| A. | 用小刀将金属钠切成小块 | |
| B. | 灼热的铁丝在Cl2中燃烧 | |
| C. | 刚切开的金属钠放置在空气中会变暗 | |
| D. | Cl2使湿润的红色纸条褪色 |
9.燃烧a g乙醇(液),生成二氧化碳气体和液态水,放出的热量为Q kJ,经测定,生成的CO2与足量澄清石灰水反应得到5g沉淀,则乙醇燃烧的热化学方程式是( )
| A. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1)△H=-20Q kJ/mol | |
| B. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(l)△H=-40Q kJ/mol | |
| C. | $\frac{1}{2}$C2H5OH(1)+$\frac{3}{2}$O2(g)=CO2(g)+$\frac{3}{2}$H2O(g)△H=-20Q kJ/mol | |
| D. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)△H=-40Q kJ/mol |
6.已知15.5gCO、HCOOCH3、HCHO、CH3COOH的混合物在O2中完全燃烧都生成水和CO2,将其产物通过足量的Na2O2后,则Na2O2固体增重为( )
| A. | 14.7g | B. | 16.1g | C. | 15.5g | D. | 无法确定 |
3.下列有关物质的性质或应用正确的是( )
| A. | 钠与硫酸铜溶液反应会置换出红色的铜 | |
| B. | 常温下干燥氯气与铁不反应,可以用钢瓶储存液氯 | |
| C. | SO2具有漂白性,通入紫色石蕊溶液中能使溶液先变红后褪色 | |
| D. | 普通玻璃的组成可用Na2O•CaO•6SiO2表示,是纯净物 |
7.氯化铜晶体在工业上可用作木材防腐剂,媒染剂等.现有含少量FeCl2的酸性CuCl2溶液,为得到纯净的CuCl2•2H2O晶体,某研究小组按如图步骤进行提纯:

已知:相关物质的溶度积常数如表:
(1)最适合作氧化剂X的是d(填字母),加入X的目的是将Fe2+氧化成Fe3+,便于生成沉淀与Cu2+分离.
a.HNO3 b.NaClO c.KMnO4d.H2O2
(2)①为使Fe3+完全除去而不损失Cu2+的目的,加入的物质Y可以是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式).
②调节至pH为3时,铁离子刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续调节至pH为4时,Cu2+开始沉淀(假定Cu2+浓度为3.0mol•L-1).
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.38g试样溶于水,加入过量KI固体,充分反应生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL. (已知:2Cu2++4I-═2CuI↓+I2I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.
②达到滴定终点时,俯视滴定管读数将使测定结果偏低(填“偏高”、“偏低”或“无影响”).
③该试样中CuCl2•2H2O的质量百分含量为90%.

已知:相关物质的溶度积常数如表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 3.0×10-20 | 1.0×10-38 | 1.7×10-7 | 1.3×10-12 |
a.HNO3 b.NaClO c.KMnO4d.H2O2
(2)①为使Fe3+完全除去而不损失Cu2+的目的,加入的物质Y可以是CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3(填化学式).
②调节至pH为3时,铁离子刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续调节至pH为4时,Cu2+开始沉淀(假定Cu2+浓度为3.0mol•L-1).
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.38g试样溶于水,加入过量KI固体,充分反应生成白色沉淀.用0.1000mol•L-1Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL. (已知:2Cu2++4I-═2CuI↓+I2I2+2S2O32-═S4O62-+2I-)
①可选用淀粉溶液作滴定指示剂.
②达到滴定终点时,俯视滴定管读数将使测定结果偏低(填“偏高”、“偏低”或“无影响”).
③该试样中CuCl2•2H2O的质量百分含量为90%.
 :3-甲基-3-戊醇
:3-甲基-3-戊醇 :4-甲基-2-戊烯
:4-甲基-2-戊烯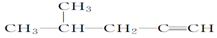 :4-甲基-1-戊炔
:4-甲基-1-戊炔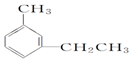 :1-甲基-3-乙苯(或间甲乙苯).
:1-甲基-3-乙苯(或间甲乙苯).