题目内容
6.镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的.工业流程如图:
(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用石灰乳,要使MgSO4完全转化为沉淀,加入试剂的量应为过量.
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是过滤.
(3)试剂②选用盐酸;写出其反应的离子方程式Mg(OH)2+2H+═Mg2++2H2O.
(4)无水MgCl2在熔融状态下,通电后可制备金属镁,该反应的化学方程式为:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(5)加入试剂①后,第一步分离得到的溶液主要为粗盐,实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明后两种情况下使用玻璃棒的目的:
①溶解:搅拌,加速固体溶解.
②过滤:引流,防止液体外溅.
③蒸发:搅拌,防止因局部过热而使液体或晶体飞溅.
分析 (1)利用复分解反应及MgSO4转化为Mg(OH)2时阴离子的变化来选择试剂,除杂试剂要过量;
(2)分离固体和液体用过滤,利用溶解性的差异来分析;
(3)根据框图从氢氧化镁到氯化镁的反应分析;
(4)电解熔融的氯化镁制备金属镁;
(5)玻璃板在过滤中引流,防止液体外溅;在蒸发中搅拌,防止因局部过热而使液体或晶体飞溅.
解答 解:(1)使MgSO4转化为Mg(OH)2,应选择碱,在转化中不引入新的离子,则试剂①选择石灰乳,为了使镁离子完全转化,加入试剂①的量应过量,
故答案为:石灰乳;过量;
(2)过滤适用于不溶于水的固体和液体,分离固体和液体用过滤,所以分离得到Mg(OH)2沉淀的方法是过滤,故答案为:过滤;
(3)从氢氧化镁到氯化镁,氢氧化镁和盐酸反应得到氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O,所以离子方程式为Mg(OH)2+2H+=Mg2++2H2O,故答案为:盐酸;Mg(OH)2+2H+=Mg2++2H2O;
(4)氯化镁电解为分解反应,产物为镁和氯气,故答案为:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;
(5)玻璃板在过滤中引流,防止液体外溅;在蒸发中搅拌,防止因局部过热而使液体或晶体飞溅,故答案为:引流,防止液体外溅;搅拌,防止因局部过热而使液体或晶体飞溅.
点评 本题考查了从海水中提取镁的反应原理,利用所学知识结合流程图信息是解答本题的关键,难度不大.

练习册系列答案
相关题目
16.下列分子叫手性分子的是( )
| A. | CH3CH2OH | B. | COOH-CHOH-CHCl-COOH | ||
| C. | CFCl3 | D. | CH2OH-CHOH-CH2OH |
14.相同条件下,相同质量的乙烯和CO具有相同的( )
(1)分子数(2)体积(3)密度(4)原子数.
(1)分子数(2)体积(3)密度(4)原子数.
| A. | 仅(1)(2) | B. | (1)(2)(3) | C. | (1)(2)(3)(4) | D. | 以上都不相同 |
18.有关化学用语正确的是( )
| A. | 硫酸钠的电离方程式:Na2SO4=Na2++SO42- | |
| B. | Mg2+的结构示意图: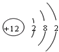 | |
| C. | 氮气的结构式::N≡N: | |
| D. | 氯化镁的电子式: |
15.下列叙述正确的是( )
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 电解是把电能转化成化学能 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH | |
| D. | 钢铁发生电化学腐蚀时生成Fe3O4 |
16.下列有机物可以发生消去反应且所得产物无同分异构体的是( )
| A. | CH3OH | B. |  | ||
| C. |  | D. |  |
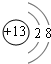 .
. ;
;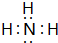 ,G的结构式为
,G的结构式为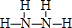 .
.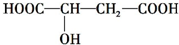

 .
. .
. $→_{Na_{2}CO_{3}/NMP}^{Pd/C}$
$→_{Na_{2}CO_{3}/NMP}^{Pd/C}$  +HBr.
+HBr.