题目内容
20.铁、钴(Co)、镍(Ni)是同族元素,都是较活泼的金属,它们的化合物在工业上有重要的应用.(1)草酸钴(CoC₂O?)是一种难溶于水的浅粉红色粉末,通常用硫酸钴溶液和草酸铵溶液反应制得,写出该反应的离子方程式:C₂O?2-+Co2+=CoC₂O?↓
(2)现将含0.5mol FeCl3的溶液和含0.5mol KSCN的溶液混合,混合后溶液体积为1L,已知溶液存在平衡:Fe3++SCN-?Fe(SCN)2+(忽略其它过程).平衡浓度c[Fe(SCN)2+]与温度T的关系如图1所示:则该反应△H< 0(填“>”或“<”),温度为T1时,反应在5秒钟时达到平衡,平衡时c[Fe(SCN)2+]=0.45mol/L,求达到平衡时的平均反应速率
v(SCN-)=0.09mol•L-1•S-1,该温度下的Fe3+的平衡转化率为90%,该温度下反应的平衡常数为180.

(3)已知某溶液中,Co2+、Ni2+的浓度分别为0.60mol/L和1.2mol/L,取一定量的该溶液,向其中滴加NaOH溶液,当Co(OH)2开始沉淀时,溶液中 $\frac{c(C{O}^{2+})}{c(N{i}^{2+})}$ 的值等于3.0.(取两位有效数字)
(已知Ksp[Co(OH)2]=6.0×10-15,Ksp[Ni(OH)2]=2.0×10-15)
(4)工业上还可用通过电解浓NaOH溶液制备Na2FeO4,其工作原理如图2所示,则阳极的电极反应式为Fe+8OH--6e-=FeO42-+4H2O.
分析 (1)硫酸钴溶液和草酸铵溶液发生复分解反应生成难溶的草酸钴,根据元素守恒和电荷守恒书写离子方程式;
(2)根据平衡移动原理可知,升高温度平衡向吸热的反应方向移动,据此可判断反应的△H;根据
$v=\frac{△c}{t}$计算反应速率,转化率=$\frac{已转化的量}{起始的量}$×100%,平衡常数等于生成物浓度的系数次幂之积除以反应物浓度的系数次幂之积,据此答题;
(3)Ksp[Co(OH)2]=6.0×10-15,Ksp[Ni(OH)2]=2.0×10-15,对于同种类型的沉淀,Ksp越小,越难溶,则在滴加氢氧化钠溶液的过程中,二价镍离子先沉淀,Ni2++2OH-=Ni(OH)2↓,当Co2+开始沉淀时,溶液中存在两个溶解平衡:Co(OH)2?CO2++2OH-,Ni(OH)2?Ni2++2OH-,根据Ksp[Co(OH)2]计算出此时溶液中c(OH-),则可计算出此时溶液中剩下的镍离子浓度,最终得出溶液中$\frac{c(Co{\;}^{2+})}{c(Ni{\;}^{2+})}$的值;
(4)依据图阳极是铁,故阳极上铁放电生成FeO42-结合碱性环境来写出电极方程式;
解答 解:(1)硫酸钴溶液和草酸铵溶液发生复分解反应生成难溶的草酸钴,反应的离子方程式为C₂O?2-+Co2+=CoC₂O?↓,
故答案为:C₂O?2-+Co2+=CoC₂O?↓;
(2)根据平衡移动原理可知,升高温度平衡向吸热的反应方向移动,根据图可知,升高温度,c[Fe(SCN)2+]的值减小,所以△H<0,反应在5秒钟时达到平衡,平衡时c[Fe(SCN)2+]=0.45mol/L,则达到平衡时的平均反应速率v(SCN-)=v[Fe(SCN)2+]=$\frac{0.45}{5}$mol•L-1•S-1=0.09mol•L-1•S-1,参加反应的Fe3+的物质的量为0.45mol,所以Fe3+的转化率=$\frac{0.45}{0.5}$×100%=90%,平衡时各物质的浓度为:c(Fe3+)=c(SCN-)=0.05mol/L,c[Fe(SCN)2+]=0.45mol/L,所以平衡常数K=$\frac{0.45}{0.05×0.05}$=180,
故答案为:<;0.09;90%;180;
(3)Ksp[Co(OH)2]=6.0×10-15,Ksp[Ni(OH)2]=2.0×10-15,对于同种类型的沉淀,Ksp越小,越难溶,则在滴加氢氧化钠溶液的过程中,二价镍离子先沉淀,Ni2++2OH-=Ni(OH)2↓,
当Co2+开始沉淀时,溶液中存在两个溶解平衡:CO(OH)2?CO2++2OH-,Ni(OH)2?Ni2++2OH-,
根据Ksp[Co(OH)2]计算出此时溶液中c(OH-),c(OH-)=$\sqrt{\frac{K{\;}_{SP[Co}{\;}_{(OH){\;}_{2}}]}{c(Co{\;}^{2+})}}$=$\sqrt{\frac{6.0×10{\;}^{-15}}{0.6}}$=10-7mol/L,
则溶液中剩下的镍离子浓度c(Ni2+)=$\frac{K{\;}_{SP}[Ni(OH){\;}_{2}]}{c{\;}^{2}(OH{\;}^{-})}$=$\frac{2.0×10{\;}^{-15}}{(10{\;}^{-7})^{2}}$=0.2mol/L,溶液中$\frac{c(Co{\;}^{2+})}{c(Ni{\;}^{2+})}$=$\frac{0.6mol/L}{0.2mol/L}$=3.0,
故答案为:3.0;
(4)阳极是铁,故阳极上铁放电生成FeO42-,由于是碱性环境,故电极方程式为:Fe+8OH--6e-=FeO42-+4H2O,
故答案为:Fe+8OH--6e-=FeO42-+4H2O.
点评 本题考查了铁及其化合物的知识,涉及反应热的判断、转化率、平衡常数的计算、难溶电解质的计算、电极反应的书写等,综合性强,有一定难度,应注意基础知识的灵活运用.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案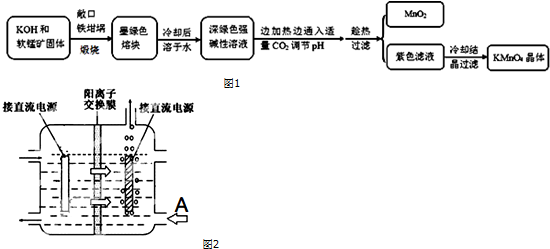
相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是强碱腐蚀石英;
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低.请写出实验中通入适量CO2时体系中可能发生反应离子方程式:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-,2OH-+CO2═CO32-+H2O;
其中氧化还原反应中氧化剂和还原剂的质量比为1:2.
(3)由于CO2的通入量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸.从理论上分析,选用下列酸中A,得到的产品纯度更高.
A.醋酸 B.浓盐酸 C.稀硫酸
(4)工业上采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2KMnO4+H2↑+2KOH
提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.
使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.
| A. | 使用催化剂能够降低化学反应的反应热(△H) | |
| B. | 金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关 | |
| C. | SO2的水溶液能够导电,所以SO2是电解质 | |
| D. | 在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小 |
| A. | 将溶质用蒸馏水溶解后,未冷却即转移至容量瓶中并定容 | |
| B. | 未洗涤溶解溶质用的烧杯及玻璃棒 | |
| C. | 定容时仰视刻度线观察液面 | |
| D. | 容量瓶中原来含有少量蒸馏水 |
| A. | 硫化钠的电子式: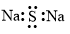 | |
| B. | HClO4的电离方程式:HClO4?H++ClO4- | |
| C. | 乙酸的结构简式:C2H4O2 | |
| D. | Mg2+的结构示意图: |

 (2)Cl-
(2)Cl-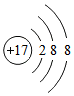 .
.