题目内容
1.下列对有机物结构或性质的描述中,错误的是( )| A. | 苯分子中的6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间的独特的键 | |
| B. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| C. | 乙烷和丙烯的物质的量共1 mol,其混合物完全燃烧生成3 mol H2O | |
| D. | 将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应 |
分析 A.苯中不含碳碳双键,为平面正六边形;
B.光照下甲基上H被取代,催化剂条件下苯环上H被取代;
C.乙烷和丙烯均含6个H;
D.苯与溴水不反应,发生萃取.
解答 解:A.苯中不含碳碳双键,为平面正六边形,6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间的独特的键,故A正确;
B.光照下甲基上H被取代,催化剂条件下苯环上H被取代,则Cl2可在甲苯的苯环或侧链上发生取代反应,故B正确;
C.乙烷和丙烯均含6个H,由H原子守恒可知,乙烷和丙烯的物质的量共1 mol,其混合物完全燃烧生成3 mol H2O,故C正确;
D.苯与溴水不反应,发生萃取,不发生加成反应,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的结构、性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意苯中的化学键,题目难度不大.

练习册系列答案
相关题目
10.84消毒液在日常生活中使用广泛,该消毒液无色、有漂白作用,它的有效成分是( )
| A. | NaOH | B. | Na2CO3 | C. | NaClO | D. | Na2O2 |
9.对MnO2、SO2、O2三种物质的组成叙述正确的是( )
| A. | 都含有氧气 | B. | 都含有氧元素 | C. | 都含有氧分子 | D. | 都含有2个氧原子 |
6.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 碳酸氢钠溶液中:K+、SO42-、Cl-、Al3+ | |
| B. | $\frac{{K}_{w}}{c({H}^{+})}$=1.0×10-13mol•L-1的溶液中:NH4+、Ca2+、Cl-、NO3- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 有SO42-存在的溶液中:Na+、Mg2+、Ca2+、I- |
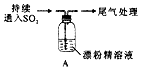
10.某化学兴趣小组的同学们对SO2与漂粉精、过氧化钠的反应进行实验探究:
【实验I】SO2与漂粉精反应.
(1)Cl2和Ca(OH)2制取漂粉精的反应中氧化剂与还原剂的物质的量之比为1:1.
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是碱性、漂白性.
(3)兴趣小组将A中产生的白雾引出导入硝酸酸化的AgN03溶液中,有沉淀产生,据此判断白雾成分为HCl小液滴,该结论合理吗?不合理请说明理由因为白雾中可能含有少量Cl2和SO2,也容易产生沉淀.
(4)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.该反应的离子方程式为ClO-+Cl-+2H+=2H2O+Cl2↑.
(5)①将A瓶中混合物过滤、洗涤,得到沉淀X,X的成分是CaSO4(填化学式);
②用离子方程式解释现象3中黄绿色褪去的原因Cl2+SO2+2H2O=4H++2Cl-+SO42-.
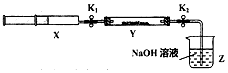
【实验II】SO2与过氧化钠反应.将一定量(过量)SO2充入注射器X中,硬质玻璃管Y中加入少量过氧化钠,两端用夹子K1、K2夹好.在室温下按图示装置进行实验,请填写空白.
【实验I】SO2与漂粉精反应.
| 操作 | 现象 |
| 取4g 漂粉精固体,加入100mL 水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH 试纸先变蓝(约为12),后褪色 |
 | 1.液面上方出现白雾; 2.稍后,出现浑浊,溶液变为黄绿色; 3.稍后,产生大量白色沉淀,黄绿色褪去 |
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是碱性、漂白性.
(3)兴趣小组将A中产生的白雾引出导入硝酸酸化的AgN03溶液中,有沉淀产生,据此判断白雾成分为HCl小液滴,该结论合理吗?不合理请说明理由因为白雾中可能含有少量Cl2和SO2,也容易产生沉淀.
(4)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应.该反应的离子方程式为ClO-+Cl-+2H+=2H2O+Cl2↑.
(5)①将A瓶中混合物过滤、洗涤,得到沉淀X,X的成分是CaSO4(填化学式);
②用离子方程式解释现象3中黄绿色褪去的原因Cl2+SO2+2H2O=4H++2Cl-+SO42-.
【实验II】SO2与过氧化钠反应.将一定量(过量)SO2充入注射器X中,硬质玻璃管Y中加入少量过氧化钠,两端用夹子K1、K2夹好.在室温下按图示装置进行实验,请填写空白.

| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应) | (1)淡黄色固体变为白色粉末 | (2)反应的化学方程式:SO2+Na2O2=Na2SO4 |
| 将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 | (3)Z中NaOH溶液倒吸入Y管中 | (4)不用解释 |