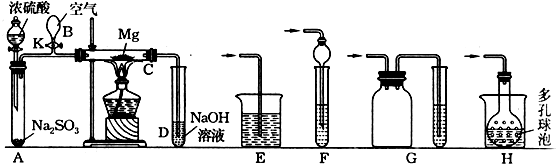
题目内容
1.过氧化钠与铝粉混合物共18.3g,加入100mL 水,充分反应后混合物完全溶解,并收集到5.6L气体(标准状况)(1)写出所发生的化学反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑
收集到的气体成份是氧气、氢气,其体积比是2:3.
(2)计算反应后溶液中各溶质的物质的量浓度(该溶液体积不变)
分析 (1)发生反应有:2Na2O2+2H2O=4NaOH+O2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)生成的气体为氧气与氢气,过氧化钠与Al都反应,令过氧化钠与Al的物质的量分别为x mol、y mol,根据二者质量之和及生成气体的体积之和列方程,据此计算解答;
(3)结合方程式计算判断NaOH是否完全反应、生成偏铝酸钠的物质的量,确定NaOH物质的量,再根据c=$\frac{n}{V}$计算.
解答 解:(1)发生反应有:2Na2O2+2H2O=4NaOH+O2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)发生反应有:2Na2O2+2H2O=4NaOH+O2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,生成的气体为氧气与氢气,
令过氧化钠与Al的物质的量分别为x mol、y mol,过氧化钠与Al都反应,则:
2Na2O2+2H2O=4NaOH+O2↑,
xmol 2xmol 0.5xmol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
ymol ymol ymol 1.5ymol
所以$\left\{\begin{array}{l}{78x+27y=18.3}\\{0.5x+1.5y=\frac{5.6}{22.4}}\end{array}\right.$
解得:x=0.2,y=0.1,
故生成氧气与氢气的体积之比为0.5×0.2mol:1.5×0.1mol=2:3,
故答案为:氧气、氢气;2:3;
(3)由方程式可知,过氧化钠反应生成氢氧化钠为2×0.2mol=0.4mol,Al反应消耗的NaOH为0.1mol、生成的偏铝酸钠为0.1mol,故溶液中氢氧化钠为0.4mol-0.1mol=0.3mol,
溶液中氢氧化钠的物质的量浓度=$\frac{0.3mol}{0.1L}$=3mol/L,
偏铝酸钠的物质的量浓度=$\frac{0.1mol}{0.1L}$=1mol/L,
答:溶液中氢氧化钠的物质的量浓度为3mol/L,偏铝酸钠的物质的量浓度为1mol/L.
点评 本题考查混合物的有关计算,难度中等,注意题目中物质全部反应,注意题目涉及过量计算,充分利用方程式计算.

 活力课时同步练习册系列答案
活力课时同步练习册系列答案| 化学式 | 电离平衡常数 |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+CO2+H2O=NaHCO3+HCN.
(3)现有浓度为0.02mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是B、D.
A.c(H+)>c(OH-)
B.c(H+)<c(OH-)
C.c(H+)+c(HCN)=c(OH-)
D.c(HCN)+c(CN-)=0.01mol/L
(4)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理Al3++3HCO3-=Al(OH)3↓+3CO2↑.
(5)已知NaHC2O4水溶液显酸性,请写出该溶液中各离子浓度的大小c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);电荷守恒表达式c(OH-)+c(HC2O4-)+2c (C2O42-)=c(H+)+c(Na+).
(6)H2C2O4溶液和KMnO4酸性溶液可发生反应:H2C2O4+MnO4-+H+→CO2+Mn2++H2O,反应中每生成标况下4.48LCO2气体,转移的电子的物质的量为0.2mol.
| A. | 升高熔点 | B. | 降低熔点 | C. | 减小硬度 | D. | 增强抗腐蚀能力 |
| A. | 酸雨是指pH<7的酸性降水 | |
| B. | 淡水的密度小于海水的密度 | |
| C. | 蒸馏法是海水淡化的方法之一 | |
| D. | 融化的雪水中矿物质含量比深井水中的少 |
| A. | NH4+、HCO3-、SO42-、Cl- | B. | CO32-、Cl-、K+、Na+ | ||
| C. | Na+、SO42-、CO32-、Cl- | D. | SO42-、Fe3+、Na+、K+ |
 )是显影技术中的中间体.回答下列问题:
)是显影技术中的中间体.回答下列问题: .
.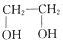 )可合成环酯,该反应的化学方程式为
)可合成环酯,该反应的化学方程式为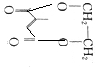 .
.