题目内容
3.某地区的湖水中可能含有K+、NH4+、Fe3+、Al3+、Mg2+、CO32-、S2O32-、SO42-中的若干种,某研究小组为确定其成分,设计并完成了如下的实验:
已知:Ag2SO4+4S2O32-═2[Ag(S2O3)2]3-+SO42-、Ag2CO3+4S2O32-═2[Ag(S2O3)2]3-+CO32-则下列说法中正确的是( )
| A. | 试样溶液中肯定存在S2O32-、CO32-,可能含有NH4+、Al3+、K+ | |
| B. | 沉淀1的成分肯定为BaSO4和S的混合物 | |
| C. | 将少量气体1通入溶液2中肯定会产生白色沉淀 | |
| D. | 取少量溶液1滴加KSCN溶液,溶液显红色 |
分析 试样中加入过量稀盐酸和氯化钡溶液,生成气体1和沉淀1,且该气体能使澄清石灰水变浑浊,说明含有CO32-或S2O32-或二者都有,也可能含有SO42-;沉淀1可能是S或BaSO4或二者混合物;
溶液1中加入足量NaOH溶液,溶液2没有明显现象,说明原溶液中不含Fe3+、Al3+、Mg2+;
向试样中加入少量硝酸银溶液,无明显现象,说明溶液中一定含有S2O32-;
根据以上现象无法确定是否含有K+、NH4+,据此分析解答.
解答 解:试样中加入过量稀盐酸和氯化钡溶液,生成气体1和沉淀1,且该气体能使澄清石灰水变浑浊,说明含有CO32-或S2O32-或二者都有,也可能含有SO42-;沉淀1可能是S或BaSO4或二者混合物;
溶液1中加入足量NaOH溶液,溶液2没有明显现象,说明原溶液中不含Fe3+、Al3+、Mg2+;
向试样中加入少量硝酸银溶液,无明显现象,说明溶液中一定含有S2O32-;
根据以上现象无法确定是否含有K+、NH4+,
A.试样溶液中肯定存在S2O32-,可能含有CO32-或SO42-或二者都有,可能含有NH4+、K+,一定没有Al3+,故A错误;
B.沉淀1的成分可能为BaSO4、BaCO3、S或它们的混合物,故B错误;
C.气体1为二氧化碳或二氧化硫,二氧化碳或二氧化硫与NaOH反应生成碳酸根离子、亚硫酸根离子,碳酸根离子、亚硫酸根离子和钡离子反应生成沉淀,故C正确;
D.溶液1中不含铁离子,所以取少量溶液1滴加KSCN溶液,溶液不显红色,故D错误;
故选C.
点评 本题考查物质检验实验方案设计,为高频考点,明确物质性质及物质之间反应是解本题关键,注意:亚硫酸根离子能和稀盐酸反应生成气体和沉淀,为易错点.

练习册系列答案
相关题目
8.下列描述及热化学方程式均正确的是( )
| A. | 已知C2H6的燃烧热为1090 kJ•mol-1,则C2H6燃烧的热化学方程式为:C2H6(g)+3.5O2(g)═2CO2(g)+3H2O(g)△H=-1090 kJ/mol | |
| B. | 25℃,101kPa下,l mol C6H6燃烧生成CO2和液态水时放出3260 kJ热量,其热化学方程式为:C6H6(g)+7.5O2(g)═6CO2(g)+3H2O (l)△H=-3260kJ•mol-1 | |
| C. | 已知常温下:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则稀醋酸与稀NaOH溶液反应生成1 mol H2O(l)时也放出57.3 kJ的热量 | |
| D. | 已知2CO(g)+O2(g)═2CO2(g)△H=-566 kJ•mol-1,则CO的燃烧热△H=-283 kJ•mol-1 |
15. 工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.
工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.
反应Ⅰ2CO(g)+SO2(g)?2CO2(g)+S(1)△H1
(1)已知:反应Ⅱ2CO2(g)?2CO(g)+O2(g)△H2=+566.0kJ•mol-1
反应ⅢS(1)+O2(g)?SO2(g)△H3=-296.0kJ•mol-1则△H1=-270KJ•mol-1.
(2)T℃时,起始将0.100mol CO(g)和0.120mol S02(g)充人2L恒容密闭容器中,发生反应Ⅰ,各物质的物质的量随时间变化如下表所示.
①下列事实能说明该反应达到化学平衡状态的是AC (填选项字母).
A.容器内压强不再改变 B.每消耗2mol C02,同时生成2mol CO
C.气体密度不再改变 D.v正( S02)=2v逆(C02)
②0~2min内,用CO表示的该反应的平均速率v(CO)=-7.5×10-3mol?L-1?min-1;平衡时,S02的转化率为25%.
③t℃时,反应I的平衡常数K=50.
④t℃时,若将上述气体充人起始容积为2L的恒压密闭容器中,反应达到平衡时,S02的转化率与原平衡相比增大.(填“增大”、“减小”或“不变”).
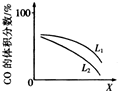
(3)L(L1、L2),X可分别代表压强或温度.如图表示t一定时,反应Ⅱ中CO(g)的体积分数随x的变化关系.
①X代表的物理量为压强.
②判断L1、L2的大小关系,并简述理由:L1>L2(或T1>T2),该反应正向为吸热反应,压强一定时,温度升高,反应向正向移动,CO的体积分数增大.
 工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.
工业上可以利用反应I所示原理降低污染气体的排放,并回收燃煤痼气中的硫.反应Ⅰ2CO(g)+SO2(g)?2CO2(g)+S(1)△H1
(1)已知:反应Ⅱ2CO2(g)?2CO(g)+O2(g)△H2=+566.0kJ•mol-1
反应ⅢS(1)+O2(g)?SO2(g)△H3=-296.0kJ•mol-1则△H1=-270KJ•mol-1.
(2)T℃时,起始将0.100mol CO(g)和0.120mol S02(g)充人2L恒容密闭容器中,发生反应Ⅰ,各物质的物质的量随时间变化如下表所示.
| 时间/min 物质的量/mol 物质 | 0 | 2 | 4 | 6 | 8 | 10 |
| CO(g) | 0.100 | 0.070 | 0.050 | 0.044 | 0.040 | 0.040 |
| SO2(g) | 0.120 | 0.105 | 0.095 | 0.092 | 0.090 | 0.090 |
A.容器内压强不再改变 B.每消耗2mol C02,同时生成2mol CO
C.气体密度不再改变 D.v正( S02)=2v逆(C02)
②0~2min内,用CO表示的该反应的平均速率v(CO)=-7.5×10-3mol?L-1?min-1;平衡时,S02的转化率为25%.
③t℃时,反应I的平衡常数K=50.
④t℃时,若将上述气体充人起始容积为2L的恒压密闭容器中,反应达到平衡时,S02的转化率与原平衡相比增大.(填“增大”、“减小”或“不变”).
(3)L(L1、L2),X可分别代表压强或温度.如图表示t一定时,反应Ⅱ中CO(g)的体积分数随x的变化关系.
①X代表的物理量为压强.
②判断L1、L2的大小关系,并简述理由:L1>L2(或T1>T2),该反应正向为吸热反应,压强一定时,温度升高,反应向正向移动,CO的体积分数增大.
12.已知在25℃、101kPa下,1g C8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ 热量.表示辛烷燃烧热的热化学方程式正确的是( )
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-48.40kJ•mol-1 | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2 (g)+9H2O(l)△H=-5517.60kJ•mol-1 | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(g)△H=-5517.60kJ•mol-1 | |
| D. | 2C8H18(l)+25O2(g)═16CO2 (g)+18H2O(l)△H=-11035.20kJ•mol-1 |
13.下列液体PH值小于7的是( )
| A. | 酒精溶液 | B. | 蔗糖溶液 | C. | 澄清石灰水 | D. | 胃液 |
 .该物质中几种元素的第一电离能由大到小的顺序是N>O>C>H,该物质的晶体中肯定不存在的作用力是d.
.该物质中几种元素的第一电离能由大到小的顺序是N>O>C>H,该物质的晶体中肯定不存在的作用力是d.

 (填结构简式).
(填结构简式).