题目内容
7.下列材料保护的措施中,利用原电池反应使主要金属得到保护的是( )| A. | 将搪瓷快餐杯脱瓷的部位用醇酸油漆涂严实,防止杯被腐蚀 | |
| B. | 将自行车的铁链条涂上植物油,防止链条被腐蚀 | |
| C. | 将埋在地下的铜水管缠上废铁丝,防止水管被腐蚀 | |
| D. | 将待埋在地下的木头桩先用火将表面烧焦,防止木材被腐蚀 |
分析 根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.只要在下列金属防腐措施中能构成原电池的就是利用了原电池原理.
解答 解:A、将搪瓷快餐杯脱瓷的部位用醇酸油漆涂严实,只是阻止了金属和电解质溶液、空气接触,不能构成原电池,所以不是利用原电池原理,故A错误.
B、将自行车的铁链条涂上植物油,阻止了金属和电解质溶液接触、空气,不能构成原电池,不是原电池原理,故B错误.
C、将埋在地下的铜水管缠上废铁丝,Fe、Cu和电解质溶液能构成原电池,较活泼的金属Fe作负极,Fe在反应中失去电子被氧化,从而Cu水管被保护,所以是利用原电池原理,故C正确.
D、将待埋在地下的木头桩先用火将表面烧焦,生成碳单质,碳在常温下较稳定,能防止木材被腐蚀,与原电池原理无关,故D错误.
故选C.
点评 本题考查了金属的腐蚀与防护,题目难度不大,会运用化学知识解决生产、生活问题,学以致用.

练习册系列答案
相关题目
17.下列化合物中同分异构体数目(不考虑立体异构)最少的是( )
| A. | 分子式为C5H12的烃 | B. | 分子式为C4H10O的醇 | ||
| C. | 分子式为C4H8的烯烃 | D. | 分子式为C3H6O2的酯 |
18.过氧化钠具有强氧化性.下列说法不正确的是( )
| A. | 过氧化钠与二氧化硫反应时可生成硫酸钠 | |
| B. | 1mol过氧化钠中阴离子数目约为6.02×1023 | |
| C. | Na2O2与CO2反应时,Na2O2是氧化剂CO2是还原剂 | |
| D. | 将等物质的量的Na2O和Na2O2分别溶于等质量的足量水中所得溶液的质量相等 |
2.常温下,下列各组离子能在指定环境中大量共存的是( )
| A. | pH=13的溶液:SO32-、Na+、Al3+ | |
| B. | 使甲基橙溶液变红色的溶液:Na+、SO42-、CO32- | |
| C. | 在c(H+)=10-12mol/L的溶液:NH4+、Cl-、NO3- | |
| D. | 加入足量Na2O2后的溶液:K+、Cl-、ClO- |
12.某烃的一种同分异构体在核磁共振氢谱中出现一组峰,该烃的分子式可以是( )
| A. | C3H8 | B. | C4H10 | C. | C5H12 | D. | C6H14 |
19.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 物质的量浓度为0.5 mol•L-1 的MgCl2溶液,含有的Cl- 数目为0.5NA | |
| B. | 常温常压下,80g SO3含有的氧原子数为3NA | |
| C. | 常温常压下,22.4L H2中所含原子数为2NA | |
| D. | 标准状况下,22.4L水中所含的分子数为NA |
16.如图所示的四种实验操作对应描述正确的是( )
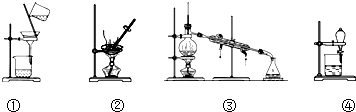

| A. | 除去KCl溶液中的K2CO3,加入适量Ca(NO3)2溶液,再用①装置分离 | |
| B. | 用②装置除去自来水中的Cl-等杂质 | |
| C. | 回收碘的CCl4溶液中的CCl4,可选用③装置 | |
| D. | 分离水和植物油,选用④装置,下层的植物油可从分液漏斗的下层放出 |
17.同温同压下,下列气体的密度最大的是( )
| A. | 氢气 | B. | 二氧化硫 | C. | 氧气 | D. | 二氧化碳 |