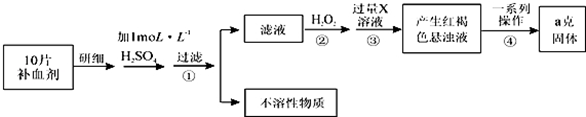
题目内容
19.铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途.下列关于铝的说法正确的是( )| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与任何酸、碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富,仅次于铁 | |
| D. | 工业上通常用钠与铝盐溶液反应来制备铝 |
分析 A.氧化铝为致密的结构;
B.Al与酸、碱均反应;
C.Al为地壳中含量最多的金属元素;
D.Al为活泼金属,电解氧化铝制备Al.
解答 解:A.铝的表面容易被氧化生成氧化铝,为致密的氧化膜结构,所以抗腐蚀性能好,故A正确;
B.常温下Al与盐酸、NaOH均反应生成盐和氢气,故B错误;
C.Al为地壳中含量最多的金属元素,则含量高,储量丰富,故C错误;
D.Al为活泼金属,工业上可以用电解法冶炼铝,即用电解熔融的氧化铝制备Al,而不是用钠与铝盐溶液反应来制备铝,与氯化铝反应首先是钠与水反应,故D错误;
故选A.
点评 本题考查Al的化学性质,把握Al与氧气、酸、碱的反应及含量、金属冶炼等知识即可解答,注重基础知识的考查,题目难度不大,选项D为解答的易错点.

练习册系列答案
相关题目
9.1mol某烃最多能与2molHCl发生加成反应,生成的产物最多能与8mol Cl2发生取代反应,则该烃的化学式是( )
| A. | C4H6 | B. | C3H6 | C. | C3H8 | D. | C5H8 |
10.某温度下,CuSO4饱和溶液的质量分数为a%,取一定量的此饱和溶液,向其中加入m g无水CuSO4,在温度不变的情况下析出W g CuSO4•5H2O晶体,则原饱和溶液中溶质CuSO4的质量减少( )
| A. | m×a% | B. | W×a% | C. | (m+W)×a% | D. | (W-m)×a% |
7.下列物质属于纯净物的是( )
①天然气 ②铝热剂 ③纯碱 ④漂白粉 ⑤胆矾 ⑥纯净的矿泉水⑦氢氧化铁胶体.
①天然气 ②铝热剂 ③纯碱 ④漂白粉 ⑤胆矾 ⑥纯净的矿泉水⑦氢氧化铁胶体.
| A. | ①③⑤⑥ | B. | ③⑤⑥ | C. | ②④⑦ | D. | ③⑤ |
14.下列各组物质按单质、氧化物、混合物的顺序排列的是( )
| A. | 冰、干冰、赤铁矿 | B. | 氢气、生石灰、煤 | ||
| C. | 红磷、纯碱、石油 | D. | 金刚石、熟石灰、空气 |
11.下列离子组能够大量共存的是( )
| A. | 无色溶液中:Cu2+、K+、NO3-、Cl- | |
| B. | 使pH试纸显红色的溶液中:Fe2+、K+、NO3-、Cl- | |
| C. | 含MnO4-的溶液中:Fe3+、SO42-、NO3-、Mg2+ | |
| D. | 与铝作用生成氢气的溶液中:Mg2+、NO3-、K+、Cl- |
8.下列离子方程式书写正确的是( )
| A. | 在100ml 1mol•L-1的Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| B. | 在100ml 2mol•L-1的FeI2的溶液中通入标况下5.6L的Cl2:4Fe2++6I-+5Cl2═4Fe3++3I2+10Cl- | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| D. | AlCl3溶液中加入过量的NaOH溶液:Al3++4OH-═AlO2-+2H2O |
9.下列各组离子能大量共存,当溶液中c(H+)=10-1mol/L时,有气体产生;而当溶液中c(H+)=10-13mol/L时,又能生成沉淀.该组离子可能是( )
| A. | Na+、Cu2+、NO3-、CO32- | B. | Ba2+、K+、Cl-、HCO3- | ||
| C. | Fe2+、Na+、SO42-、NO3- | D. | Mg2+、NH4+、SO42-、Cl- |