题目内容
3. 石蜡油(主要是含17个碳原子以上的液态烷烃混合物)分解实验按照如图进行:
石蜡油(主要是含17个碳原子以上的液态烷烃混合物)分解实验按照如图进行:(1)石蜡油分解实验产生的气体的主要成分是③(填写序号,下同)
①只有甲烷
②只有乙烯
③烷烃跟烯烃的混合物
(2)将石蜡油分解所得生成物通入到溴水中,现象是溴水褪色;通入到酸性高锰酸钾溶液中,现象是酸性高锰酸钾溶液褪色.
(3)碎瓷片的作用是②③(填序号).
①防止暴沸 ②有催化功能③积蓄热量 ④作反应物
(4)写出含有18个碳原子的烷烃分解为乙烷与最多乙烯的化学方程式:C18H38$→_{△}^{催化剂}$C2H6+8C2H4.
分析 (1)石蜡油分解生成烯烃和烷烃;
(2)烯烃中含有碳碳双键导致烯烃性质较活泼,能被酸性高锰酸钾氧化、能和溴发生加成反应;
(3)碎瓷片有催化和积蓄热量作用;
(4)根据反应物、生成物和反应条件书写方程式.
解答 解:(1)石蜡油主要是含17个碳原子以上的液态烷烃混合物,在加热条件下,石蜡油分解生成烯烃,根据原子守恒知,除了生成烯烃外还生成烷烃,故选③;
(2)石蜡油的分解产物中含有烯烃,烯烃中含有碳碳双键导致烯烃性质较活泼,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,能和溴发生加成反应而使溴水褪色,所以看到的现象是:溴水褪色、酸性高锰酸钾溶液褪色,故答案为:溴水褪色;酸性高锰酸钾溶液褪色;
(3)加热石蜡油时加入碎瓷片,石蜡油分解较缓慢,加热碎瓷片能加快反应速率,碎瓷片还能吸收热量而积蓄热量从而促进石蜡油分解,故选②③;
(4)18个碳原子烷烃的分子式为C18H38,C18H38分解生成乙烷与乙烯,且它们的物质的量之比为1:8,该反应方程式为C18H38$→_{△}^{催化剂}$C2H6+8C2H4,
故答案为:C18H38$→_{△}^{催化剂}$C2H6+8C2H4.
点评 本题以石蜡油分解生成乙烯为载体考查了乙烯的性质、反应方程式的书写等知识点,明确物质的性质是解本题关键,知道烯烃中碳碳双键导致烯烃性质较活泼,注意:烯烃使高锰酸钾溶液和溴水褪色原理不同,一个发生氧化反应、一个发生加成反应.

练习册系列答案
相关题目
2.向100mL pH=l的H2SO4溶液中,滴加0.01mol/L的NaOH溶液,当所得混合液的pH为2时,加入NaOH溶液的体积是( )
| A. | 10 mL | B. | 90 mL | C. | 100 mL | D. | 450 mL |
3.关于下列装置说法正确的是( )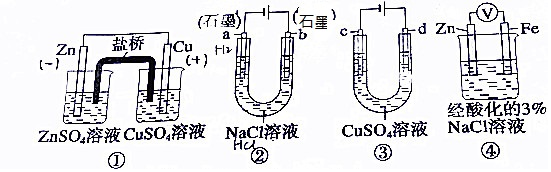

| A. | 装置①中,盐桥中的K+移向ZnSO4溶液 | |
| B. | 装置②工作一段后,a极附近的溶液pH增大,滴加酚酞为红色 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④中电子由Zn流向Fe,加入K3[Fe(CN)6]溶液产生蓝色沉淀 |
11.水蒸气通过炽热的炭层时,发生反应:C+H2O$\frac{\underline{\;高温\;}}{\;}$H2+CO,该反应类型属于( )
| A. | 化合反应 | B. | 置换反应 | C. | 分解反应 | D. | 复分解反应 |
18.氧化还原反应是一类重要的化学反应,广泛存在于自然界中,对人们的生产、生活有着十分重要的作用.你认为下列对氧化还原反应的描述不正确的是( )
| A. | 肯定有电子得失 | |
| B. | 肯定是有关氧元素的反应 | |
| C. | 肯定有化合价的变化 | |
| D. | 氧化剂得到电子总数与还原剂失去电子总数相等 |
8.苯环和侧链相互影响,下列关于甲苯的实验事实中,能说明侧链对苯环有影响的是( )
| A. | 甲苯能使酸性KMnO4溶液褪色 | |
| B. | 甲苯能与浓硝酸浓硫酸反应生成三硝基甲苯 | |
| C. | 甲苯能与H2发生加成反应 | |
| D. | 甲苯能萃取溴水中的溴 |
15.有Fe 2+、NO3-、Fe 3+、NH4+、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
| A. | 氧化剂和还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 每1 mol NO3-发生还原反应,转移6 mol e- | |
| D. | 若把该反应设计为原电池,则负极反应为Fe2+-e-═Fe3+ |
12.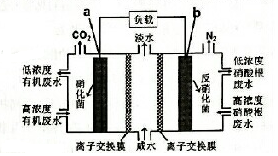 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )
 一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )
一种三室微生物燃料电池污水净化系统原理如图所示,图中废水有机物可用 C6H10O5表示.下列有关该燃料电池的说法的是( )| A. | a电极为该电池的正极 | |
| B. | 电极b的反应式:2NO3--10e-+12H+=N2↑+6H2O | |
| C. | 每处理1molC8H10O5,b电极将产生3.2molN2 | |
| D. | a电极离子交换膜允许Na+白中间空迁有机废水处理室 |