题目内容
13.下列叙述正确的是( )| A. | 电解饱和食盐水时,用铁作阳极,Cl-发生氧化反应 | |
| B. | 铅蓄电池放电时,负极质量减轻,正极质量增加 | |
| C. | 马口铁(镀锡铁)镀层破损后即失去保护作用 | |
| D. | 钢铁发生电化学腐蚀的负极反应式:Fe-3e-═Fe3+ |
分析 A、电解池中 铁做阳极会失电子生成亚铁离子,溶液中氯离子不能失电子;
B、铅蓄电池放电时,负极反应为:Pb-2e-+SO42-=PbSO4,正极的反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;
C、原电池的负极是容易有被氧化的电极,易被腐蚀;
D、钢铁发生电化学腐蚀的负极反应式:Fe-2e-═Fe2+.
解答 解:A、电解池中铁做阳极会失电子生成亚铁离子,溶液中氯离子不能失电子,应是石墨做阳极,溶液中氯离子失电子发生氧化还原反应,故A错误;
B、铅蓄电池放电时,负极反应为:Pb-2e-+SO42-=PbSO4,正极的反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O,所以正负极质量都增大,故B错误;
C、马口铁(镀锡铁)镀层破损后,形成原电池,原电池的负极是铁,是容易被氧化的电极,易被腐蚀,即失去保护作用,故C正确;
D、钢铁发生电化学腐蚀的负极反应式:Fe-2e-═Fe2+,故D错误;
故选C.
点评 本题考查了电解池、原电池原理的分析判断,电极反应和电极判断是解题关键,掌握基础是关键,题目难度中等.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
1.现有a、b、c、d四种金属片,①若将a、b用导线连接后浸入稀硫酸,b上有气泡产生;②若将c、d用导线连接浸入稀硫酸,c发生氧化反应;③若将b、c用导线连接浸入稀硫酸,电子的方向是:b→c.则下列说法正确的是( )
| A. | 金属的活泼顺序为:a>c>b>d | |
| B. | 在①的溶液中,SO42-向b极移动 | |
| C. | 在③的装置中,一段时间后b电极质量将会减轻 | |
| D. | 二次电池放电时的反应和充电时的反应是可逆反应 |
8.已知在溶液中,KCl、K2SO4、ZnSO4、ZnCl2完全以离子形式存在.体积相同的两份植物营养液,其配方如下:
两份营养液中各离子的浓度( )
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| (1) | 0.3mol | 0.2mol | 0.1mol | / |
| (2) | 0.1mol | 0.3mol | / | 0.1mol |
| A. | 完全相同 | B. | 完全不同 | C. | 仅c(K+)相同 | D. | 仅c(Cl-)相同 |
18.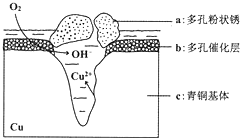 如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )
如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )
 如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )
如图所示为青铜器在潮湿环境中发生的电化学腐蚀的示意图,下列说法错误的是( )| A. | 腐蚀过程中,铜被氧化 | |
| B. | 已知环境中的 Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,则其离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓ | |
| C. | 若生成 4.29 g Cu2(OH)3Cl,则理论上耗氧体积定为 0.448 L | |
| D. | 正极的电极反应式为:O2+4e-+2H2O=4OH- |
5.下列陈述Ⅰ、Ⅱ正确并有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | 氢氟酸具有酸性 | 氢氟酸可用于雕刻玻璃 |
| B | 氯水显酸性 | 可用pH试纸测氯水的pH |
| C | NH3极易溶于水 | NH3可用作制冷剂 |
| D | ClO2具有强氧化性 | ClO2可用于自来水的杀菌消毒 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
3.化学与生活密切相关,下列有关说法正确的是( )
| A. | 油脂、乙酸乙酯都属于酯类,水解后都会生成乙醇 | |
| B. | 人的皮肤在强紫外线的照射下将会失去生理活性 | |
| C. | 棉花和蚕丝的主要成分都是纤维素 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
 ;检验元素X、Y、Z以质量比为1:7:12形成的化合物中所含阳离子的离子反应方程式是:
;检验元素X、Y、Z以质量比为1:7:12形成的化合物中所含阳离子的离子反应方程式是: