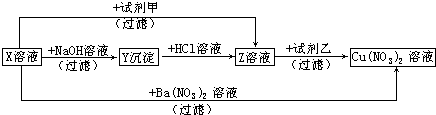
题目内容
11.若要配制480mL0.1mol/L的硫酸铜溶液,以下操作正确的是( )| A. | 称取7.68g硫酸铜,加入500mL水 | B. | 称取12.5g胆矾配成500mL溶液 | ||
| C. | 称取8.0g硫酸铜,加入500mL水 | D. | 称取12.0g胆矾配成500mL溶液 |
分析 配制480mL0.1mol/L的硫酸铜溶液,应选500mL容量瓶,若利用硫酸铜固体,需要硫酸铜的质量为0.5L×0.1mol/L×160g/mol=8.0g,若利用胆矾固体,需要质量为0.5L×0.1mol/L×250g/mol=12.5g,最终均配制成500mL溶液,以此来解答.
解答 解:A.500mL水为溶剂的体积,不能配制480mL0.1mol/L的硫酸铜溶液,故A错误;
B.称取12.5g胆矾配成500mL溶液,可配制480mL0.1mol/L的硫酸铜溶液,故B正确;
C.500mL水为溶剂的体积,不能配制480mL0.1mol/L的硫酸铜溶液,故C错误;
D.胆矾固体的质量为0.5L×0.1mol/L×250g/mol=12.5g,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握溶液配制、物质的量相关计算及仪器的选择为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.

练习册系列答案
相关题目
9.某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L.
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液
依然澄清,且溶液中阴离子种类与原溶液中种类相同.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)仅由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO+2H2O.
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为3NO2+H2O=2HNO3+NO
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
(5)工业废水中常含有不同类型的污染物,可采用不同的方法处理.以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是D.
| 阳离子 | K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 | Cl- CO 32- NO3- SO42- SiO32- |
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察).
Ⅱ.取少量溶液,加入KSCN溶液无明显变化.
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液
依然澄清,且溶液中阴离子种类与原溶液中种类相同.
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成.
请推断:
(1)仅由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是K+、Fe3+(写离子符号).
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是3Fe2++NO3-+4H+=3Fe3++NO+2H2O.
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为3NO2+H2O=2HNO3+NO
(4)甲同学最终确定原溶液中所含阳离子是Fe2+、Cu2+,阴离子是Cl-、NO3-、SO42-.(写离子符号)
(5)工业废水中常含有不同类型的污染物,可采用不同的方法处理.以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是D.
| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加生石灰中和 | 物理法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 化学法 |
| C | 含复杂有机物的废水 | 通过微生物代谢 | 物理法 |
| D | 碱性的废水 | 用CO2来中和 | 化学法 |
6.下列排列顺序正确的是( )
| A. | 热稳定性:HBr<HCl<HF | B. | 原子半径:I<Br<Cl | ||
| C. | 酸性:HClO4<HBrO4<HIO4 | D. | 非金属性:F<Cl<Br |
1.下列叙述正确的是( )
| A. | 250C101KPa条件下,1摩尔任何气体的体积都是22.4升 | |
| B. | 标准状况下,体积是22.4升的物质,其物质的量一定是1摩尔 | |
| C. | 同温同压下两种气体,只要分子数相同,所占体积相同,质量也相同 | |
| D. | 同质量的O2和O3所含的氧原子数相同 |
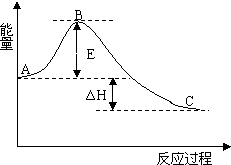 2SO2(g)+O2(g)=2SO3(g) 反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题:
2SO2(g)+O2(g)=2SO3(g) 反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ•mol-1.请回答下列问题: