题目内容
7.若手指不小心沾了一些KMnO4溶液,皮肤上的黑斑很久才能消除,如果用草酸的稀溶液洗涤马上可消除,离子方程式为2MnO4-+5H2C2O4+6H+→10CO2↑+2Mn2++8H2O□(未配平).(1)□中所缺物质化学式为H2O,配平上述离子方程式.
(2)上述反应中H2C2O4作还原剂,氧化性:MnO4->CO2(填“>“或“<“)
(3)1molMnO4-在反应中得到5NA个电子.
(4)已知草酸的浓度为0.2mol•L-1,若生成标况下44.8LCO2,则消耗草酸的体积为5L.
分析 (1)反应中高锰酸根离子中+7价锰元素化合价降为+2价锰离子,草酸中+3价碳化合价升高为+4价,依据得到电子守恒、原子个数守恒配平方程式,判断缺少物质;
(2)反应物中所含有元素化合价升高的为还原剂,对应氧化产物,反应物中所含有元素化合价降低的为氧化剂,对应产物为还原产物,对应氧化产物;氧化还原反应中氧化剂氧化性强于氧化产物氧化性;
(3)依据MnO4-~Mn2+~5e-解答;
(4)依据2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,结合碳原子个数守恒:H2C2O4~2CO2计算.
解答 解:(1)反应中高锰酸根离子中+7价锰元素化合价降为+2价锰离子,草酸中+3价碳化合价升高为+4价,要得失电子守恒,则高锰酸根离子系数为2,草酸分子系数为5,依据原子个数守恒、电荷守恒规律,缺少物质为H2O,二氧化碳系数为10,氢离子系数为6,水分子系数为8,方程式:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O;
故答案为:2;5;6;10;2;8H2O;
(2)反应中高锰酸根离子中+7价锰元素化合价降为+2价锰离子,草酸中+3价碳化合价升高为+4价,所以氧化剂为:MnO4-;还原产物为:2Mn2+;还原剂为:H2C2O4;氧化产物为:CO2;依据氧化还原反应中氧化剂氧化性强于氧化产物氧化性,所以氧化性:MnO4->CO2;
故答案为:H2C2O4;>;
(3)依据MnO4-~Mn2+~5e-可知:1molMnO4-在反应中得到 5NA个电子;
故答案为:5NA;
(4)依据2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,结合碳原子个数守恒:H2C2O4~2CO2则:
H2C2O4~2CO2则
1mol 44.8L
n 44.8L
解得n=1mol,则:V=$\frac{n}{C}$=$\frac{1mol}{0.2mol/L}$=5L;
故答案为:5.
点评 本题考查了氧化还原反应,涉及氧化还原反应配平、基本概念判断,明确氧化还原反应得失电子守恒、原子个数守恒是解题关键,题目难度中等.

| A. |  烧碱 烧碱 | B. |  甲烷 | C. |  酒精 | D. |  镁条 |
| A. | KClO3═K++3O2-+Cl5+ | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaHS?Na++HS- | D. | HCO3-?H++CO32- |
| A. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| B. | 用热的纯碱溶液去油污效果更好 | |
| C. | 制备无水的AlCl3、FeCl3均不能采用将溶液在空气中直接蒸干的方法 | |
| D. | 室温下,向0.1mol/L的HF溶液中加入少量水溶液显碱性的物质,HF的电离程度一定增大 |
| A. | 目前工业上主要采用接触法制硫酸,并使用热交换器充分利用反应中放出的热量 | |
| B. | 从海水中提取溴,是将提取粗盐后的母液浓缩、氧化,使溶液中的溴离子发生氧化反应转化成溴单质,就得到粗溴 | |
| C. | 工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 | |
| D. | 离子交换膜在工业生产中广泛应用,如氯碱工业使用了阳离子交换膜 |
| A. | 称取7.68g硫酸铜,加入500mL水 | B. | 称取12.5g胆矾配成500mL溶液 | ||
| C. | 称取8.0g硫酸铜,加入500mL水 | D. | 称取12.0g胆矾配成500mL溶液 |
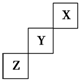
| A. | X、Y、Z三种元素中,与H2化合最容易的是X元素 | |
| B. | 最高价氧化物对应的水化物的酸性:Y>Z | |
| C. | Y的最高正化合价为+7价 | |
| D. | X单质的熔点比Z的低 |
| A. | 标准状况下,2.24L氯气溶于水发生反应,转移的电子数目为0.1NA | |
| B. | 常温常压下,16g O2和O3混合气体中,含氧原子的总数为1NA | |
| C. | 1L1 mol•L-1的NH4NO3溶液中含有NH4+数目为NA | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中OH-的数目为0.01NA |
 ;
;