题目内容
8.肉桂酸甲酯(代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精.用质谱法测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.利用红外光谱仪可初步检测有机化合物中的某些基团,现测得M分子的红外光谱如图: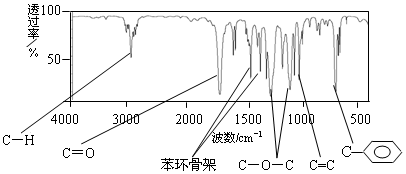
根据以上信息确定肉桂酸甲酯的分子式为C10H10O2,结构简式为
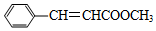 .
.
分析 相对分子质量为162,分子中C、H、O原子个数比为5:5:1,则分子式应为C10H10O2,分子中只含有1个苯环,苯环上只有一个取代基,核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3,则结构简式为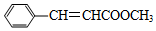 ,含有碳碳双键和苯环,可发生加成反应,含有酯基,可发生水解反应,以此解答该题.
,含有碳碳双键和苯环,可发生加成反应,含有酯基,可发生水解反应,以此解答该题.
解答 解:设M的分子式为(C5H5O)n,其相对分子质量为162,则n=$\frac{162}{12×5+1×5+16}$=2,所以M的分子式为:C10H10O2,该分子中只含有1个苯环,苯环上只有一个取代基,M的核磁共振氢谱谱图有6个峰,说明含有6种氢原子,其面积之比为1:2:2:1:1:3,峰面积之比等于氢原子个数之比,根据红外光谱可知结构简式应为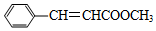 ,
,
故答案为:C10H10O2;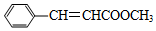 .
.
点评 本题考查有机物的推断,为高频考点,侧重于学生的分析能力的考查,注意把握题给信息以及有机物的结构和性质,难度中等.

练习册系列答案
相关题目
19.在铅蓄电池的充放电过程中,涉及不到的物质是( )
| A. | PbS | B. | PbO2 | C. | PbSO4 | D. | Pb |
19.下列物质在空气中不易变质的是( )
| A. | FeSO4 | B. | NaClO | C. | Na2SiO3 | D. | NaHSO4 |
16.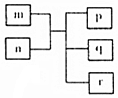 短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )
 短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )
短周期主族元素X、Y、Z、W原子序数依次递增,Y原子最外层电子数为次外层电子数的二倍.m为元素Y的单质,n为元素Z的最高价氧化物的水化物,p、q、r分别为上述四种元素组成的二元化合物.下列说法正确的是( )| A. | 原子半径Y<Z<W | |
| B. | 简单气态氢化物的稳定性Y>Z>W | |
| C. | X与Z形成的化合物的水溶液一定为酸性溶液 | |
| D. | X、Z、W三种元素可以形成离子化合物 |
3.具有下列原子序数的各组元素,能组成化学式AB2型化合物,并且该化合物在固态时为原子晶体的是( )
| A. | 6和8 | B. | 20和17 | C. | 14和8 | D. | 6和16 |
13.海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示.下列描述错误的是( )


| A. | 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法 | |
| B. | 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品 | |
| C. | 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小 | |
| D. | 用SO2水溶液吸收Br2的离子反应方程式为Br2+SO2+2H2O═4H++SO42-+2Br- |
20.大海是一个资源宝库,从海水中提取镁和溴的实验如下:
Ⅰ.(1)海水提镁的步骤如下,请在横线上将实验步骤、目的补充完整.
(2)结合以上实验步骤,列举一个能与海水提镁相联合的工业生产实例制备盐酸.
Ⅱ.已知海水中溴元素主要以Br-形式存在,工业上从海水中提取溴的流程如下:

(1)吸收塔1中发生反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
(2)吸收塔2中发生反应:3Br2+3Na2CO3=NaBrO3+3CO2+5NaBr.当3mol Br2完全反应时转移电子5mol.
(3)吸收塔3中反应的离子方程式为5Br-+BrO3-+6H+=Br2+3H2O.
(4)吹出塔、吸收塔2的作用分别是用热空气把生成的溴单质吹出,富集溴.
Ⅰ.(1)海水提镁的步骤如下,请在横线上将实验步骤、目的补充完整.
| 实验步骤 | 实验目的 |
| ①将贝壳煅烧后制成石灰乳. | |
| ②将海水进行浓缩. | |
| ③加入石灰乳沉淀过滤. | 沉淀镁离子生成氢氧化镁沉淀 |
| ④向步骤③所得物质中加入稀盐酸,将溶液进行蒸发浓缩、结晶、过滤. | |
| ⑤将得到的产物干燥除水后,MgCl2 $\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑(填化学方程式)得到金属镁. |
Ⅱ.已知海水中溴元素主要以Br-形式存在,工业上从海水中提取溴的流程如下:

(1)吸收塔1中发生反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
(2)吸收塔2中发生反应:3Br2+3Na2CO3=NaBrO3+3CO2+5NaBr.当3mol Br2完全反应时转移电子5mol.
(3)吸收塔3中反应的离子方程式为5Br-+BrO3-+6H+=Br2+3H2O.
(4)吹出塔、吸收塔2的作用分别是用热空气把生成的溴单质吹出,富集溴.
18.下列理论解释和结论都正确的是( )
| 选项 | 理论解释 | 结论 |
| A | H-N的键能大于H-P | 沸点:NH3>PH3 |
| B | 离子半径:Mg2+<Ba2+ | 热分解温度:碳酸镁髙于碳酸钡 |
| C | 离子半径:Na+<Cs+ | 配位数(C.N.):NaCl<CsCl |
| D | 晶格能:FeS2>ZnS | 岩浆中的硫化物矿物析出顺序ZnS先于FeS2 |
| A. | A | B. | B | C. | C | D. | D |

 .
.