题目内容
15.根据下面的信息,下列叙述不正确的是( )
| A. | 化学键的断裂和形成是物质在化学反应中发生能量变化的主要原因 | |
| B. | 水分解生成氢气跟氧气的同时吸收能量 | |
| C. | 1mol H2跟$\frac{1}{2}$mol O2反应生成1mol H2O释放能量一定为245kJ | |
| D. | 为开发氢能,可研究设法将太阳能聚焦,产生高温使水分解产生氢气 |
分析 A.依据信息中化学键的断裂吸收的能量和形成化学键放出的热量分析判断;
B.依据化学键的键能以及可逆反应的热效应相反分析判断;
C.依据键能计算反应的热效应,反应物的键能之和减去生成物的键能之和分析判断;注意物质的聚集状态;
D.用水制取新能源氢气,水在高温下也可以分解,设法将太阳光聚焦,产生高温使水分解产生氢气,可行.
解答 解:反应的焓变=反应物键能之和-生成物的键能之和=436KJ+249KJ-930KJ=-245KJ,所以反应是放热反应;热化学方程式为:H2(g)+1/2O2(g)=H2O(g)△H=-245KJ/mol,
A.化学键的断裂吸收的能量和形成化学键放出的热量是化学反应中发生能量变化的主要原因,故A正确;
B.根据以上计算可知,氢气与氧气反应生成水是放热反应,所以水分解生成氢气跟氧气的同时吸收能量,故B正确;
C.1molH2(g)与0.5molO2(g)反应生成1molH2O(g),释放能量245KJ,气态水变为液态水时放出热量,所以1molH2(g)与0.5molO2(g)反应生成1molH2O(l),释放能量大于245KJ,故C错误;
D.太阳能是一种廉价能源.水在高温下可以分解,设法将太阳光聚焦,产生高温,使水分解产生氢气和氧气.氢气具有可燃性,可作为新能源.故D正确;
故选C.
点评 本题考查了反应的热效应的计算依据和判断方法,题目难度中等,注意明确旧键断裂吸热热量,新键形成放出热量,要求学生能够依据化学键的键能来计算判断吸热反应和放热反应,即:反应的热效应=反应物的键能之和-生成物的键能之和.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.如表根据实验事实所作结论中,正确的是( )
| 实 验 事 实 | 结 论 | |
| A | A、B两种有机物具有相同的相对分子质量和不同的结构 | A、B互为同分异构体 |
| B | 质量相同的A、B两种有机物完全燃烧生成质量相同的水 | A、B两有机物最简式相同 |
| C | A、B两种有机物结构相似具有相同的通式 | A、B互为同系物 |
| D | 分子式为C6H6的烃A既能使溴的CCl4溶液褪色,又能使酸性KMnO4溶液褪色 | A的结构简式可能是 CH2═CH-C≡C-CH═CH2 |
| A. | A | B. | B | C. | C | D. | D |
6.用含有A12O3、SiO2和少量FeO•xFe2O3的铝灰制备A12(SO4)3•18H2O.工艺流程如图:

(一定条件下,MnO4-可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
(1)H2SO4溶解A12O3的离子方程式是Al2O3+6H+=2Al3++3H2O;
(2)检验滤液中还存在Fe2+的方法是取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色(注明试剂、现象).
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的将Fe2+氧化为Fe3+;调节溶液的pH为3.2的目的是调节pH值使铁元素沉淀完全.
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是有黄绿色气体生成,写出其反应方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
③Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式).

(一定条件下,MnO4-可与Mn2+反应生成MnO2)
已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 2.7 |
| 完全沉淀时 | 5.2 | 9.7 | 3.2 |
(2)检验滤液中还存在Fe2+的方法是取少量滤液,滴加KMnO4溶液,KMnO4溶液褪色(注明试剂、现象).
(3)“除杂”环节有如下几个步骤:
(Ⅰ)向滤液中加入过量KMnO4溶液,调节溶液的pH为3.2;
(Ⅱ)加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
(Ⅲ)加入MnSO4至紫红色消失,过滤.
①步骤Ⅰ的目的将Fe2+氧化为Fe3+;调节溶液的pH为3.2的目的是调节pH值使铁元素沉淀完全.
②向Ⅱ的沉淀中加入浓HCl并加热,能说明沉淀中存在MnO2的现象是有黄绿色气体生成,写出其反应方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
③Ⅲ中加入MnSO4的目的是除去过量的MnO4-.
(4)从多次循环使用后母液中可回收的主要物质是K2SO4(填化学式).
7.下列说法不正确的是( )
| A. | 因为水果中一般含有各种芳香族有机酸,食用时能感到较强的酸味,刺激食欲 | |
| B. | 猪肉因含有 而有香味,该物质属于烃的衍生物,能发生加聚反应 而有香味,该物质属于烃的衍生物,能发生加聚反应 | |
| C. | 除去苯中 的方法:加溴水,充分振荡,静置分液 的方法:加溴水,充分振荡,静置分液 | |
| D. | 在分子筛固体酸作催化剂的条件下,用苯和丙烯反应制备异丙苯,符合绿色化学工艺 |
4.如表实验不能达到预期目的是( )
| 序号 | 实验操作 | 实验目的 |
| A | 浓、稀HNO3分别与Cu反应 | 比较浓、稀HNO3的氧化性强弱 |
| B | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| D | 测定等浓度的HCl、HNO3两溶液的pH | 比较Cl、N的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
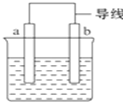 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题: 和
和 ;⑦
;⑦ 和
和 ;
;