题目内容
4.下列关于能量的变化及反应热的说法中正确的是( )| A. | 需要加热才能发生的反应都是吸热反应 | |
| B. | 已知1mol CO(g)完全燃烧时放出283.0kJ热量,则表示CO(g)燃烧热的热化学方程式为 2CO(g)+O2(g)═2CO2(g);△H=-566.0kJ/mol | |
| C. | △H<0、△S<0的反应肯定是自发的 | |
| D. | 任何化学反应都有反应热 |
分析 A、吸热反应实质是反应物所具有的总能量低于生成物所具有的总能量;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
C、反应能否自发进行,取决于焓变和熵变的综合判据,当反应的△H-T•△S<0时,反应可自发进行,据此解答;
D、任何化学反应都有化学键的断裂与生成,都有能量变化.
解答 解:A、需要加热才能发生的反应不一定是吸热反应,如铝热反应需要在高温下发生,但是放热反应,故A错误;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;热化学方程式不符合概念,故B错误;
C、△H<0,△S<0,△H-T•△S要小于0,取决于温度T,所以反应不一定能自发进行,故C错误;
D、化学反应的过程,就是旧键断裂新键生成的过程,断裂化学键需吸收能量,形成化学键会释放能量,故D正确.
故选D.
点评 本题分析焓变与化学键的关系,以及化学键与物质能量大小的关系,题目较简单,是一道基础题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.三种有机物A、B、C的分子式均为C3H6O2,且C中无甲基,把它们分别进行实验,并记录现象如下:
(1)由此推出A、B、C的结构简式为:ACH3COOCH3,BCH3CH2COOH,CCH2(OH)CH2CHO;
(2)与A互为同分异构体且满足以下条件的物质的结构简式是HCOOCH2CH3;
①只含有一个官能团 ②能发生银镜反应
(3)C与银氨溶液反应的方程式CH2(OH)CH2CHO+2Ag(NH3)2OH$\stackrel{△}{→}$2Ag↓+CH2(OH)CH2COONH4+3NH3+H2O.
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| A | 发生水解 | 无银镜反应 | 不反应 | 不反应 |
| B | 发生中和反应 | 无银镜反应 | 溶解 | 放出H2 |
| C | 不反应 | 有银镜反应 | 有红色沉淀 | 放出H2 |
(2)与A互为同分异构体且满足以下条件的物质的结构简式是HCOOCH2CH3;
①只含有一个官能团 ②能发生银镜反应
(3)C与银氨溶液反应的方程式CH2(OH)CH2CHO+2Ag(NH3)2OH$\stackrel{△}{→}$2Ag↓+CH2(OH)CH2COONH4+3NH3+H2O.
15.下列分离方法正确的是( )
| A. | 用分液法分离水和植物油 | |
| B. | 用乙醇从溴水中萃取溴单质 | |
| C. | 用蒸馏法分离水和四氯化碳 | |
| D. | 用过滤法除去氯化钠溶液中的碳酸钠 |
12. 在100mL0.1mol•L-1铝铵矾[NH4Al(SO4)2•12H2O]的水溶液中,逐滴滴入0.1mol•L-1的Ba(OH)2溶液,所得沉淀的质量与Ba(OH)2溶液的体积曲线如图所示[已知Ba(AlO2)2易溶易电离].下列说法正确的是( )
在100mL0.1mol•L-1铝铵矾[NH4Al(SO4)2•12H2O]的水溶液中,逐滴滴入0.1mol•L-1的Ba(OH)2溶液,所得沉淀的质量与Ba(OH)2溶液的体积曲线如图所示[已知Ba(AlO2)2易溶易电离].下列说法正确的是( )
 在100mL0.1mol•L-1铝铵矾[NH4Al(SO4)2•12H2O]的水溶液中,逐滴滴入0.1mol•L-1的Ba(OH)2溶液,所得沉淀的质量与Ba(OH)2溶液的体积曲线如图所示[已知Ba(AlO2)2易溶易电离].下列说法正确的是( )
在100mL0.1mol•L-1铝铵矾[NH4Al(SO4)2•12H2O]的水溶液中,逐滴滴入0.1mol•L-1的Ba(OH)2溶液,所得沉淀的质量与Ba(OH)2溶液的体积曲线如图所示[已知Ba(AlO2)2易溶易电离].下列说法正确的是( )| A. | a点溶液中大量存在的离子有NH4+和SO42- | |
| B. | b点溶液中c(NH3•H2O)约为0.1mol•L-1 | |
| C. | a→b过程中,反应的只有SO42- | |
| D. | b→c过程中,反应的是Al(OH)3和NH4+ |
19.同温同压下,某容器充满O2重116g,若充满CO2重122g,现充满某气体重114 g,则某气体的相对分子质量为( )
| A. | 28 | B. | 60 | C. | 2(100-m) | D. | 无正确选项 |
16.下列物质中既能与KMnO4溶液反应、又能与溴水反应的一组物质是( )
①苯 ②乙烯 ③CCl4 ④聚乙烯 ⑤苯乙烯 ⑥已烷.
①苯 ②乙烯 ③CCl4 ④聚乙烯 ⑤苯乙烯 ⑥已烷.
| A. | ②⑤ | B. | ②④⑤ | C. | ②③⑤ | D. | ①②③④⑤⑥ |
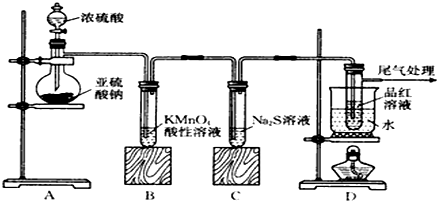
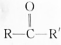 结构);B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应.试推测A、B、C的构造式.
结构);B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应.试推测A、B、C的构造式.