题目内容
17.下列关于化学反应说法中不正确的是( )| A. | 在一确定的化学反应关系中,反应物的总能量与生成物的总能量一定不相等 | |
| B. | 化学反应的特征是有新物质生成 | |
| C. | 化学反应的过程实际上是一个旧键断裂,新键生成的过程 | |
| D. | 化学反应过程中一定有热量释放出来 |
分析 A.化学反应一定伴随能量变化,吸收或放出能量;
B.化学反应中一定有新物质生成;
C.断裂化学键吸收能量,形成化学键释放能量;
D.化学反应中可能释放热量,也可能吸收热量.
解答 解:A.化学反应一定伴随能量变化,吸收或放出能量,则化学反应中反应物的总能量与生成物的总能量一定不相等,故A正确;
B.化学反应中一定有新物质生成,即化学反应的特征是有新物质生成,故B正确;
C.断裂化学键吸收能量,形成化学键释放能量,化学反应中一定有旧键断裂,新键生成,故C正确;
D.化学反应中可能释放热量,也可能吸收热量,如C与二氧化碳反应为吸热反应,故D错误;
故选D.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、化学键与能量的关系、反应的实质为解答的关键,侧重分析与应用能力的考查,注意反应可能为吸热或放热反应,题目难度不大.

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
5.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+,Fe2+,Cl-,ClO- | B. | Na+,Cu2+,SO42-,NO3- | ||
| C. | Mg2+,NH4+,SO42-,Cl- | D. | Ba2+,CO32-,NO3-,K+ |
12.蓄电池在放电时起原电池的作用,在充电时起电解池的作用.下面是某蓄电池分别在充电和放电时发生的反应:Fe+NiO2+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2下列有关该蓄电池的推断错误的是( )
| A. | 放电时,Fe是负极,NiO2是正极 | |
| B. | 蓄电池的电极可以浸入某中酸性电解质溶液中 | |
| C. | 充电时,阴极上的电极反应为:Fe(OH)2+2e-=Fe+2OH- | |
| D. | 放电时,电解质溶液中的阴离子向负极方向移动 |
2.以下物质;(1)溴乙烷;(2)苯;(3)聚氯乙烯;(4)裂化汽油;(5)聚1,3-丁二烯;(6)乙二醇;(7)邻二甲苯(8)亚硫酸氢钠;既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的有( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
9.下列说法正确的是( )
| A. | 按系统命名法,化合物  的名称为2,4-二乙基-丙基辛烷 的名称为2,4-二乙基-丙基辛烷 | |
| B. | 若两种二肽互为同分异构体,则二者的水解产物一定不相同 | |
| C. | 分子式为C5H5O2Cl并能与饱和NaHCO3溶液反应产生气体的有机物有(不含立体结构)有15种 | |
| D. | 某有机物的结构简式是  ,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应 ,该有机物能够发生加成反应、取代反应、缩聚反应和消去反应 |
7.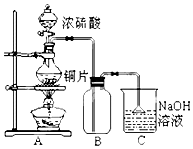 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:无必要,随着反应的进行,浓硫酸变成稀硫酸,稀硫酸与铜不反应
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:A
A.铁粉 B.钠 C.氯化钡溶液 D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度.他设计了如下二种方案来测定SO2的量:
方案①将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
方案②将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀.
经仔细分析后,发现有不合理之处,请填写表(可以不填满):
Ⅱ乙学生设计的方案是:分离出反应后的溶液并加蒸馏水稀释至1000mL,取20.00mL于锥形瓶中,滴入2~3滴酚酞指示剂,用标准NaOH溶液进行滴定(已知氢氧化铜开始沉淀的pH约为5),这种方法能否求出余酸的浓度,理由是不能,pH>5时,铜离子与碱反应生成沉淀,不能达到滴定终点.
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)方案一:取反应后的溶液,向其中加入足量锌,收集并测定氢气的体积,通过氢气的物质的量计算剩余硫酸的物质的量浓度;
方案二:反应结束后将烧瓶中的铜片取出,洗净、烘干,称其质量即可;
方案三:反应结束后将烧瓶中的铜取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量等.
 某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)
某研究性学习小组的同学为验证浓硫酸与铜能反应而稀硫酸不能,设计了如图所示装置进行探究:将6.4g 铜片和含0.2moL溶质的18.4mol/L浓硫酸放在圆底烧瓶中共热,直到无气体生成为止.(假定在此过程溶液体积不变)(1)甲同学认为要证实上述结论,还应进行稀硫酸与铜片混合加热实验,你认为有无必要,并说明理由:无必要,随着反应的进行,浓硫酸变成稀硫酸,稀硫酸与铜不反应
(2)下列试剂中能够用来进一步证明反应结束后的烧瓶中确有余酸的是:A
A.铁粉 B.钠 C.氯化钡溶液 D.银粉
(3)为定量测定余酸的物质的量浓度,甲、乙两位同学进行了如下设计:
Ⅰ甲同学设想:在A装置增加一个导管通氮气驱赶气体(假定生成的气体全部逸出),先测定生成的SO2的量,然后计算剩余硫酸的浓度.他设计了如下二种方案来测定SO2的量:
方案①将产生的气体缓缓通入足量用稀硫酸酸化的KMnO4溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀.
方案②将气体缓缓通入足量硝酸钡溶液中,然后过滤、洗涤、干燥、称量沉淀.
经仔细分析后,发现有不合理之处,请填写表(可以不填满):
| 序号 | 不合理的原因 | 误差 (偏低或偏高) | 改变措施 |
| 方案① | |||
| 方案② |
(4)请再设计其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算,不必写操作细节)方案一:取反应后的溶液,向其中加入足量锌,收集并测定氢气的体积,通过氢气的物质的量计算剩余硫酸的物质的量浓度;
方案二:反应结束后将烧瓶中的铜片取出,洗净、烘干,称其质量即可;
方案三:反应结束后将烧瓶中的铜取出,然后向溶液中加入足量氯化钡溶液,过滤出沉淀,洗净、干燥后称量等.
8.下列有关化学用语表示正确的是( )
| A. | 氯乙烯分子的结构简式:H3C-CH2Cl | B. | 硫原子的结构示意图: | ||
| C. | 过氧化钠的电子式: | D. | 中子数为10的氧原子:${\;}_{8}^{18}$O |