题目内容
17.下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是( )| A. | 氯气:K+ Ba2+ SiO32- NO3- | |
| B. | 氨气:K+ Na+ AlO2- CO32- | |
| C. | 二氧化硫:Na+ NH4+ SO32- C1- | |
| D. | 甲醛:Ca2+ Mg2+ Mn04- NO3- |
分析 A.氯气与水反应生成酸;
B.氨气与水反应生成碱;
C.二氧化硫与SO32-反应;
D.甲醛与Mn04-发生氧化还原反应.
解答 解:A.氯气与水反应生成酸,酸溶液中不能大量存在SiO32-,且Ba2+、SiO32-结合生成沉淀,不能共存,故A错误;
B.氨气与水反应生成碱,该组离子之间不反应,可大量共存,故B正确;
C.二氧化硫与SO32-反应,不能大量共存,故C错误;
D.甲醛与Mn04-发生氧化还原反应,不能大量共存,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应、氧化还原反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
7.下列说法中正确的一组是( )
| A. | H2和D2互为同位素 | B. |  和 和 互为同分异构体 互为同分异构体 | ||
| C. | 戊烷有两种同分异构体 | D. | 金刚石与石墨是同素异形体 |
8.进行下列反应后,所得溶液中一定只含有一种溶质的是( )
| A. | 将铁粉加到稀硝酸中 | |
| B. | 向稀盐酸中滴入少量的NaAlO2溶液 | |
| C. | 向MgSO4、H2SO4的混合溶液中加入过量的Ba(OH)2溶液 | |
| D. | 室温下,NaOH溶液与醋酸溶液反应后所得的pH大于7的溶液 |
12.下列离子方程式与所述事实相符且正确的是( )
| A. | 在含3.2amolHNO3的稀溶液中,加入2amol铁粉:5Fe+4NO3-+16H+═3Fe2++2Fe3++4NO↑+8H2O | |
| B. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-═Mg(OH)2↓+2CO32-+2H2O | |
| C. | 泡沫灭火器灭火时发生的反应:2Al3++3CO32-+H2O═2Al(OH)3↓+3CO2↑ | |
| D. | 将AgCl白色沉淀加入Na2S溶液中反应:2AgCl+S2-═Ag2S↓+2Cl- |
2.在体积为2L的密闭容器中充有2mol SO2和一定量的O2,发生反应2SO2+O2?2SO3.当反应进行到4min时,测得此时SO2为0.4mol,那么反应进行到2min时,密闭容器中SO2物质的量是( )
| A. | 小于1.2 mol | B. | 1.2 mol | C. | 大于1.6 mol | D. | 1.6 mol |
9.下列元素中,非金属性最强的是( )
| A. | S | B. | Mg | C. | P | D. | Cl |
6.为除去氯化氢中混有的少量水蒸气,可使气体通过洗气瓶,洗气瓶中应盛有( )
| A. | 硝酸银溶液 | B. | 浓硫酸 | C. | 纯碱溶液 | D. | 碱石灰 |
1. 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放
入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.试回答下列问题:
(1)锥形瓶中的溶液从红色变为无 色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶由此造成的测定结果偏高(偏高、偏低或无影响)
(4)步骤②缺少的操作是据酸式滴定管用蒸馏水洗净后,应用标准液润洗
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL
(6)
请计算待测烧碱溶液的浓度0.0800mol/L.
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放
入25.00mL待测溶液到锥形瓶中.
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0“刻度以下的位置,记下读数.
③向锥形瓶中滴入酚酞作指示剂,进行滴定.滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL.
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL.试回答下列问题:
(1)锥形瓶中的溶液从红色变为无 色时,停止滴定.
(2)滴定时边滴边摇动锥形瓶,眼睛应观察B
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是待测溶液润洗锥形瓶由此造成的测定结果偏高(偏高、偏低或无影响)
(4)步骤②缺少的操作是据酸式滴定管用蒸馏水洗净后,应用标准液润洗
(5)如图,是某次滴定时的滴定管中的液面,其读数为22.60mL
(6)
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前度数(mL) | 滴定后度数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
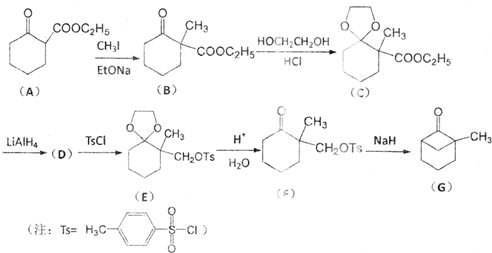
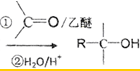
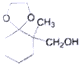 ;
; )、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(
)、乙醛、乙二醇为主要原料制备5-羟基-2-己酮(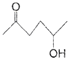 )的合成路线流程图(有机溶剂乙醚和无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH
)的合成路线流程图(有机溶剂乙醚和无机试剂任用).合成路线流程图示例如下:H2C═CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH