题目内容
12.铜与1 mol•L-1的硝酸反应时,如果硝酸根离子的浓度下降0.2 mol•L-1,则溶液中的c(H+)同时下降( )| A. | 0.2 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.6 mol•L-1 | D. | 0.8 mol•L-1 |
分析 铜与硝酸反应的方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,消耗氢离子的浓度为硝酸根离子浓度的4倍,据此计算出溶液中氢离子浓度变化.
解答 解:由铜与硝酸反应的方程式3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O可知,此反应中消耗的H+与NO3-的物质的量之比为4:1,
故溶液中的c(H+)下降了:0.2mol/L×4=0.8 mol•L-1,
故选D.
点评 本题考查了离子方程式的计算,题目难度中等,明确发生反应的实质为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
2.下列热化学方程式或离子方程式中,正确的是( )
| A. | 甲烷的燃烧热为890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃、30MPa}^{催化剂}$2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO32-+2H2O?H2CO3+2OH- | |
| D. | 纯水的电离方程式:H2O+H2O?H3O++OH- |
7.下列离子方程式书写正确的是 ( )
| A. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| B. | 向NaClO溶液中通入少量SO2:2ClO-+SO2+H2O═2HClO+SO32- | |
| C. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 向NaHSO4溶液中滴加Ba(OH)2溶液至呈中性:2H++SO42-+Ba2++2OH-═2H2O+BaSO4↓ |
17.根据原子结构及元素周期律的知识,下列叙述正确的是( )
| A. | 由于相对分子质量:HCl>HF,故沸点:HCl>HF | |
| B. | 由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 | |
| C. | 硅处于金属与非金属的过渡位置,硅可用作半导体材料 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
4.为了探究FeS04和Cu(N03)2的混合物中各组分的含量,现设计如下流程.下列叙述中错误的是( ) 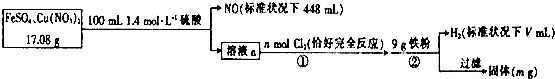

| A. | V=2240 | |
| B. | n=0.02 | |
| C. | 原混合物中FeS04的质量分数约为89% | |
| D. | m=0.6 |
1.下列实验操作中正确的是( )
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| C. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 | |
| D. | 蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 |