题目内容
4.下列溶液中,酸性最强的是( )| A. | 0.01mol/L的盐酸 | B. | 0.01mol/L的醋酸溶液 | ||
| C. | c(H+)=10-3mol/L的溶液 | D. | c(OH-)=10-1mol/L溶液 |
分析 溶液中氢离子浓度越大,溶液的酸性越强;强电解质在溶液中完全电离,弱电解质部分电离,据此对各选项进行判断.
解答 解:A.0.01mol/L的盐酸中氢离子浓度为0.01mol/L;
B.0.01mol/L的醋酸溶液中氢离子浓度小于0.01mol/L;
C.c(H+)=10-3mol/L的溶液;
D.c(OH-)=10-1mol/L溶液呈碱性;
根据分析可知,氢离子浓度最大的为A,
故选A.
点评 本题考查了溶液酸性强弱比较,题目难度不大,明确溶液酸碱性与溶液氢离子浓度的关系为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
14. 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+163.9kJ•mol-1.
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
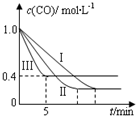
的影响,某活动小组设计了三个实验,实验曲线如图所示
①请依据实验曲线图补充完整表格中的实验条件:X=530℃,Y=5MPa.
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往10L容器中投入2.0mol CO(g)、2.0mol H2O(g)、1.0mol CO2(g)、1.0mol H2(g),此时化学反应将正向(填“正向”、“逆向”或“不”) 移动.
 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.已知:①CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.2kJ•mol-1
②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
(1)甲烷和水蒸气生成二氧化碳和氢气的热化学方程式为CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+163.9kJ•mol-1.
(2)为了探究反应条件对反应CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42.3kJ•mol-1
的影响,某活动小组设计了三个实验,实验曲线如图所示
| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
②实验Ⅲ从开始至平衡,其平均反应速度率v (CO)=0.12mol•L-1•min-1.
③实验Ⅱ达平衡时CO的转化率大于 实验Ⅲ达平衡时CO的转化率(填“大于”、“小于”或“等于”).
④在530℃时,平衡常数K=1,若往10L容器中投入2.0mol CO(g)、2.0mol H2O(g)、1.0mol CO2(g)、1.0mol H2(g),此时化学反应将正向(填“正向”、“逆向”或“不”) 移动.
15.少量铁粉与100mL 0.01mol•L-1的稀盐酸反应,反应速率太慢.为了加快此反应速率而不改变H2的产量,可以使用如下方法的( )
①加H2O
②滴入几滴CuSO4
③滴入几滴浓盐酸
④加CH3COONa固体
⑤加NaCl固体
⑥升高温度(不考虑盐酸挥发)
⑦改用10mL 0.1mol•L-1盐酸.
①加H2O
②滴入几滴CuSO4
③滴入几滴浓盐酸
④加CH3COONa固体
⑤加NaCl固体
⑥升高温度(不考虑盐酸挥发)
⑦改用10mL 0.1mol•L-1盐酸.
| A. | ①⑥⑦ | B. | ③⑤⑦ | C. | ③⑥⑦ | D. | ⑤⑥⑦ |
12.下列常温下的下列物质属于所气态有机物的是 ( )
| A. | CH3Cl | B. | CH2Cl2 | C. | CCl4 | D. | 苯 |
19.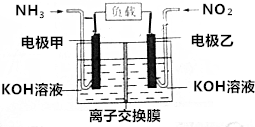 人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )
人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )
 人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )
人民网北京2015年12月1日电,为了应对持续的雾霾天气,京津冀区域多个城市迅速启动应急响应,落实应对措施.雾霾成分中含有氮的氧化物,利用反应NO2+NH3→N2+H2O制作如图所示的电池,用以消除氮氧化物的污染.下列有关该电池的说法一定正确的是( )| A. | 电极乙为电池负极 | |
| B. | 离子交换膜为质子交换膜 | |
| C. | 负极反应式为2NH3-6e-+6OH-═N2+6H2O | |
| D. | 28.0L(标准状况)NO2完全处理,转移5mol电子 |
16.某溶液中的阳离子有四种,分别是NH4+、Mg2+、Fe2+和Al3+,若向其中加入过量的NaOH溶液,微热并搅拌,再加入过量的盐酸,溶液中大量减少的金属离子是( )
| A. | Fe2+ | B. | Mg2+ | C. | Al3+ | D. | NH4+ |
17. 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(l)请完成以下实验设计表(表中不要留空格)
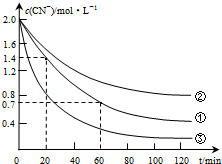
实验测得含氰废水中的总氰浓度(以CN-表示)随时间变化关系如图所示.
(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
 生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).
生产中可用双氧水氧化法处理电镀含氰废水,某化学兴趣小组模拟该法探究有关因素对破氰反应速率的影响(注:破氰反应是指氧化剂将CN-氧化的反应).【相关资料】
①氰化物主要是以CN-和[Fe(CN)6]3-两种形式存在.
②Cu2+可作为双氧水氧化法破氰处理过程中的催化剂;Cu2+在偏碱性条件下对双氧水分解影响较弱,可以忽略不计.
③[Fe(CN)6]3-较CN-难被双氧水氧化,且pH越大,[Fe(CN)6]3-越稳定,越难被氧化.
【实验过程】
在常温下,控制含氰废水样品中总氰的初始浓度和催化剂Cu2+的浓度相同,调节含氰废水样品不同的初始pH和一定浓度双氧水溶液的用量,设计如下对比实验:
(l)请完成以下实验设计表(表中不要留空格)
| 实验 序号 | 实验目的 | 初始pH | 废水样品体积/mL | CuSO4溶液的体积/mL | 双氧水溶液的体积/mL | 蒸馏水的体积/mL |
| ① | 为以下实验操作参考 | 7 | 60 | 10 | 10 | 20 |
| ② | 废水的初始pH对破氰反应速率的影响 | 12 | 60 | 10 | 10 | 20 |
| ③ | 双氧水的浓度对破氰反应速率的影响 | 7 | 60 | 10 | 20 | 10 |
(2)实验①中20~60min时间段反应速率:υ(CN-)=0.0175mol•L-1•min-1.
(3)实验①和实验②结果表明,含氰废水的初始pH增大,破氰反应速率减小,其原因可能是初始pH增大,催化剂Cu2+会形成Cu(OH)2沉淀,影响了Cu2+的催化作用(或初始pH增大,[Fe(CN)6]3-较中性和酸性条件下更稳定,难以氧化)(填一点即可).在偏碱性条件下,含氰废水中的CN-最终被双氧水氧化为HCO3-,同时放出NH3,试写出该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(4)该兴趣小组同学要探究Cu2+是否对双氧水氧化法破氰反应起催化作用,请你帮助他设计实验并验证上述结论,完成下表中内容.(己知:废水中的CN-浓度可用离子色谱仪测定)
| 实验步骤(不要写出具体操作过程) | 预期实验现象和结论 |
| 分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度 | 相同时间内,若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用;若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用 |
18.下列化学用语正确的是( )
| A. | 聚丙烯的结构简式: | B. | 丙烷分子的比例模型: | ||
| C. | 羟基的电子式: | D. | 乙烯的结构简式:CH2=CH2 |