题目内容
19.已知NaH和H2O反应生成H2和NaOH,反应中1mol NaH( )| A. | 得到1 mol e- | B. | 失去1 mol e- | C. | 失去2 mol e- | D. | 没有电子得失 |
分析 发生反应:NaH+H2O=H2↑+NaOH,反应中NaH中H元素由-1价升高为氢气中0价,H2O中H元素由+1价降低为氢气中0价.
解答 解:发生反应:NaH+H2O=H2↑+NaOH,反应中NaH中H元素由-1价升高为氢气中0价,H2O中H元素由+1价降低为氢气中0价,反应中1mol NaH失去1 mol e-,故选:B.
点评 本题考查氧化还原反应计算,比较基础,注意根据化合价分析解答.

练习册系列答案
相关题目
9.下列叙述正确的是( )
| A. | 铜能导电,所以铜是电解质 | |
| B. | 固态氯化钠不导电,但氯化钠是电解质 | |
| C. | 氯化氢水溶液能导电,所以氯化氢水溶液是电解质 | |
| D. | 三氧化硫溶于水能导电,所以,三氧化硫是电解质 |
10.下列离子方程式正确的是( )
| A. | 向氨水中滴入盐酸:H++OH-=H2O | |
| B. | 向澄清石灰水中通入少量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O | |
| C. | 稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑ | |
| D. | 钠跟水反应:Na+2H2O=Na++2OH-+H2↑ |
7.如表实验事实陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
| Ⅰ操作 | Ⅱ结论 | |
| A | 滴加用硝酸酸化的BaC12溶液生成白色沉淀 | 原溶液中有SO42- |
| B | 用洁净铂丝蘸取溶液进行焰色反应:火焰呈黄色 | 原溶液中有Na+无K+ |
| C | 滴加氯水和CC14,振荡、静置.下层溶液显紫色 | 原溶液中有I- |
| D | 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝 | 原溶液中无NH4+ |
| A. | A | B. | B | C. | C | D. | D |
4.下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).

(1)制备氯气选用的药品为二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为橙黄色,打开D装置中活塞,将D中少量溶液加入装置E中,振荡.观察到的现象是溶液分层,上层接近无色,下层(四氯化碳层)为紫红色.经认真考虑,有同学提出该实验方案仍有不足,请说明其中不足的原因是氯气氧化性也强于碘,若通入Cl2过量,可能是过量氯气置换出I2.
(5)装置F中用足量NaOH溶液吸收剩余的氯气,试写出相应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O.

(1)制备氯气选用的药品为二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 无水CaCl2 | 浓硫酸 | 无水CaCl2 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)装置F中用足量NaOH溶液吸收剩余的氯气,试写出相应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O.
11.下列说法中,正确的是( )
| A. | 单质碳具有还原性 | |
| B. | 木炭燃烧时吸收大量的热 | |
| C. | 用活性炭可除去硬水中的氯化钙杂质 | |
| D. | 金刚石、石墨都是由碳原子构成的,都很硬 |
8.对于某些离子的检验及结论正确的是( )
| A. | 加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32- | |
| B. | 加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42- | |
| C. | 某溶液中加入Na2CO3溶液后有白色沉淀,则该溶液中一定有Ca2+ | |
| D. | 某溶液的焰色反应为黄色,则该溶液中一定有Na+ |
9.下列溶液中微粒的物质的量浓度关系不正确的是( )
| A. | 若将适量CO2 通入0.1 mol•L-1Na2CO3溶液中至溶液恰好呈中性,则溶液中(不考虑溶液体积变化) 2 c(CO32ˉ)+c(HCO3ˉ)=0.1 mol•L-1 | |
| B. | 在25℃时,将c mol•L-1的醋酸溶液与0.02 mol•L-1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=$\frac{2×1{0}^{-9}}{c-0.02}$ | |
| C. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| D. | 等体积等物质的量浓度的NaClO溶液与NaCl溶液中离子总数大小:N前<N后 |
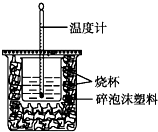 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: