题目内容
13.下列化学用语正确的是( )| A. | Cl-的结构示意图: | B. | 甲烷分子的球棍模型 | ||
| C. | 四氯化碳的电子式: | D. | 氯乙烯的结构简式:CH2=CHCl |
分析 A.氯离子的核电荷数为17,最外层达到8电子稳定结构;
B. 为甲烷的比例模型,不是球棍模型;
为甲烷的比例模型,不是球棍模型;
C.Cl最外层应为8个电子;
D.氯乙烯的结构简式要书写碳碳双键;
解答 解:A.氯离子的核外电子总数为18,最外层含有8个电子,其离子结构示意图为: ,故A错误;B.甲烷为正四面体结构,分子中含有4个碳氢键,甲烷正确的球棍模型为:
,故A错误;B.甲烷为正四面体结构,分子中含有4个碳氢键,甲烷正确的球棍模型为: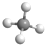 ,故B错误;
,故B错误;
C.四氯化碳的电子式为 ,故C错误;
,故C错误;
D.氯乙烯的结构简式要体现碳碳双键,所以为CH2=CHCl,故D正确;
故选D.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及电子式、离子结构示意图、结构简式、球棍模型等知识,明确常见化学用语的表示方法为解答关键,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
1.工业上用粗盐(含Ca2+、Mg2+、SO42-等杂质)为主要原料采用“侯氏制碱法”生产纯碱和化肥NH4Cl,实验室模拟工艺流程如图1所示.下列有关说法正确的是( )


| A. | 饱和食盐水中先通入的气体为CO2 | |
| B. | 流程图1中的“系列操作”中一定需要玻璃棒 | |
| C. | 如图2所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性 | |
| D. | 对粗盐溶液除杂可依次加入过量NaOH、Na2CO3、BaCl2 溶液,过滤后再加入盐酸调节溶液的pH |
18.下列有关原子结构和元素周期律表述正确的是( )
①原子序数为17的元素的最高化合价为+7
②碱金属元素是同周期中金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为26的元素位于元素周期表的第四周期ⅤⅢB族.
①原子序数为17的元素的最高化合价为+7
②碱金属元素是同周期中金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为26的元素位于元素周期表的第四周期ⅤⅢB族.
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
5.已知:Zn(s)+HgO(s)=ZnO(s)+Hg(l)△H=-259.7kJ•mol-1
2Hg(l)+O2(g)=2HgO(s)△H=-181.6kJ•mol-1
则反应2Zn(s)+O2(g)=2ZnO(s)的△H为( )
2Hg(l)+O2(g)=2HgO(s)△H=-181.6kJ•mol-1
则反应2Zn(s)+O2(g)=2ZnO(s)的△H为( )
| A. | -337.8 kJ•mol-1 | B. | -701.0 kJ•mol-1 | C. | -441.3 kJ•mol-1 | D. | -350.5kJ•mol-1 |
2.下列离子方程式书写正确的是( )
| A. | Zn与稀H2SO4反应:2Zn+2H+=2Zn2++H2↑ | |
| B. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+ | |
| C. | 碳酸氢铵溶液与足量澄清石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| D. | 固体碳酸钙中滴加足量盐酸:CaCO3+2H+=Ca2++CO2↑+H2O |
10.三氯化磷(PCl3)溶于水能发生水解反应.下列判断不正确的是( )
| A. | PCl3分子中所有原子最外层都满足8电子结构 | |
| B. | PCl3的立体构型是三角锥形 | |
| C. | PCl3属于极性键构成的非极性分子 | |
| D. | PCl3水解的产物是亚磷酸(H3PO3)和HCl |
 D.CH3COOH E.淀粉 F.葡萄糖 G.蛋白质
D.CH3COOH E.淀粉 F.葡萄糖 G.蛋白质