题目内容
2.如图甲是利用一种微生物将废水中的尿素(H2NCONH2)的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中不正确的是( )
| A. | 铜电极应与Y相连接 | |
| B. | 乙装置中溶液的颜色不会变浅 | |
| C. | 当N电极消耗0.25 mol气体时,则铁电极质量增加16 g | |
| D. | M电极反应式:H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+ |
分析 甲图能将化学能直接转化为电能,是原电池,在N极通入氧气,氧气得电子与氢离子反应生成水,则N为正极,M是负极,尿素(H2NCONH2)在负极失电子发生氧化反应生成无污染的二氧化碳、氮气,电解质溶液呈酸性;在铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极相连,根据得失电子守恒计算,以此解答该题.
解答 解:A.铁上镀铜,则铁为阴极应与负极相连,铜为阳极应与正极Y相连,故A正确;
B.在铁上镀铜,铜作阳极失电子发生氧化反应生成铜离子,铁作阴极,铜离子在阴极得电子析出铜,溶液中铜离子浓度不变,所以颜色不变,故B正确;
C.正极电极反应式为O2+4e-+4H+=2H2O,当N电极消耗0.25mol氧气时,则转移电子物质的量为0.25×4=1mol,铁电极上的电极反应为Cu2++2e-=Cu,所以铁电极增重$\frac{1mol}{2}$×64g/mol=32g,故C错误;
D.H2NCONH2在负极M上失电子发生氧化反应,生成无污染的氮气、二氧化碳,电极反应式为H2NCONH2+H2O-6e-═CO2↑+N2↑+6H+,故D正确;
故选C.
点评 本题考查了原电池原理以及电镀原理,为高频考点,侧重于学生的分析、计算能力的考查,明确原电池正负极上得失电子、串联电路中电子转移守恒即可解答,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
12.下列化工生产涉及的变化主要是物理变化的是( )
| A. | 煤的干馏 | B. | 石油的分馏 | C. | 石油的裂化 | D. | 石油的裂解 |
13.下列实验中.对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验步骤 | 现象 | 结论 |
| A | 向KI溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 碘易溶于CCl4,难溶于水 |
| B | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 产生白色沉淀,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| C | FeCl3和BaCl2混合溶液中通入足量SO2 | 溶液变为浅绿色且有白色沉淀生成 | 沉淀为BaSO3 |
| D | 向AgCl悬浊液中加入NaI溶液 | 出现黄色沉淀 | Ksp (AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
10.化学与生产、生活、科技、环境等密切相关,下列说法正确的是( )
| A. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| B. | 铅笔芯的原材料为铅,所以儿童常咬铅笔头容易铅中毒 | |
| C. | 网络飞速发展,得益于光纤良好的导电性,光纤的主要成分是二氧化硅 | |
| D. | 用K2FeO4取代Cl2处理饮用水,不仅可杀菌消毒,同时还能沉降水中的悬浮物 |
17.工业上可由乙苯(C8H10)生产苯乙烯(C8H8),其反应原理是: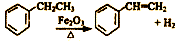 下列说法中错误的是( )
下列说法中错误的是( )
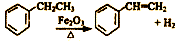 下列说法中错误的是( )
下列说法中错误的是( )| A. | 可用溴的四氯化碳来鉴别乙苯和苯乙烯 | |
| B. | 乙苯分子中所有原子可能都处于同一平面 | |
| C. | 苯乙烯可发生氧化反应、取代反应、加成反应 | |
| D. | 乙苯与苯互为同系物 |
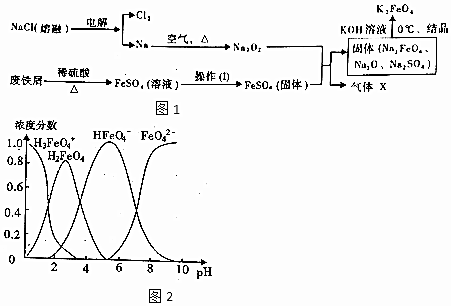
7. X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )
X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )
 X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )
X、Y、Z、W、R为原子序数依次增大的短周期元素.化合物甲由X、Z、W三种元素组成,常温下0.1mol/L甲溶液的pH=13.工业上常通过电解饱和WR溶液制得甲.Y的单质与由Y、Z组成的化合物之间的转化关系如图.下列叙述正确的是( )| A. | 简单离子的半径:W>Z>R | |
| B. | XR与XRZ均为强酸 | |
| C. | 化合物W2Z2中既含离子键又含极性键 | |
| D. | 图中转化过程发生的反应均为化合反应 |
14. 在盛有稀 H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.关于该装置,下列说法正确的是( )
在盛有稀 H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.关于该装置,下列说法正确的是( )
 在盛有稀 H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.关于该装置,下列说法正确的是( )
在盛有稀 H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.关于该装置,下列说法正确的是( )| A. | 外电路中电流方向为:X→ →Y →Y | |
| B. | 若两电极分别为铁棒和碳棒,则 X 为碳棒,Y 为铁棒 | |
| C. | X 极上发生的是还原反应,Y 极上发生的是氧化反应 | |
| D. | 若两电极都是金属单质,则它们的活动性顺序为 X>Y |
12.下列实验描述正确的是( )
| A. | 向淀粉水解后的溶液中加入碘水,溶液变蓝色,证明淀粉没有水解 | |
| B. | 向NaOH溶液中滴加浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液,出现红褐色沉淀,由此可知Ksp[Fe(OH)3]<Ksp[Al(OH)3] | |
| C. | 向待测试样中加入过量稀盐酸无现象,再滴加BaCl2溶液,有白色沉淀生成,证明试样中含SO42- | |
| D. | 将Fe(NO3)2样品溶于稀硫酸,再滴加KSCN溶液变为红色,证明样品已部分或全部变质 |