题目内容
15.金属钛的密度小,强度大,外观像钢,性质像铝,被誉为太空金属和未来钢铁.以钛.铁矿(主要成分为FeTiO3,同时含有少量的Fe2O3、FeO等)为原料制TiO2,再由TiO2制金属Ti的工艺流程如下:
(1)在溶液中加入铁屑发生的主要离子方程式为2Fe3++Fe=3Fe2+.
(2)晶体A为FeSO4•7H2O,浊液需要冷却的原因为降低温度可减小的溶解度,便于结晶析出,方便分离出TiOSO4溶液.
(3)TiOSO4水解方程式为:TiOSO4+2H2O?H2TiO3↓+H2SO4,根据平衡移动原理,可采用加水、加碱等措施,以利于该反应顺利进行.
(4)TiO2可与焦炭、氯气在1000~1100K温度下反应,该反应氧化剂与还原剂的物质的量相等,则反应的化学方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.
(5)工业上常用金属镁在1070K的高温和氩气氛围中还原TiC14的方法制备Ti,需要在氩气氛围中.进行的理由为防止钛、镁在高温下与空气中的氧气、二氧化碳等反应.
分析 钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化,热过滤后得浊液中含有FeSO4和TiOSO4,经冷却再过滤,得晶体A为FeSO4•7H2O,滤液为TiOSO4溶液,溶液发生水解生成H2TiO3,经煅烧可生成TiO2,用氯气、碳反应可生成TiCl4,高温条件下与镁反应可生成Ti,以此解答该题.
解答 解:钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化,热过滤后得浊液中含有FeSO4和TiOSO4,经冷却再过滤,得晶体A为FeSO4•7H2O,滤液为TiOSO4溶液,溶液发生水解生成H2TiO3,经煅烧可生成TiO2,用氯气、碳反应可生成TiCl4,高温条件下与镁反应可生成Ti,
(1)加入铁屑,可防止Fe2+氧化,发生的主要离子方程式为2Fe3++Fe=3Fe2+,
故答案为:2Fe3++Fe=3Fe2+;
(2)根据上面的分析可知,晶体A为FeSO4•7H2O,浊液需要冷却的原因为降低温度可减小的溶解度,便于结晶析出,方便分离出TiOSO4溶液,
故答案为:FeSO4•7H2O;降低温度可减小的溶解度,便于结晶析出,方便分离出TiOSO4溶液;
(3)TiOSO4水解方程式为:TiOSO4+2H2O?H2TiO3↓+H2SO4,根据平衡移动原理,可采用加水、加碱等措施,促使平衡正向移动,以利于该反应顺利进行,
故答案为:加水;加碱;
(4)TiO2可与焦炭、氯气在1000~1100K温度下反应,该反应中氧化剂为氯气,还原剂为碳,若它们的物质的量相等,则反应的化学方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO,
故答案为:TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;
(5)由于钛、镁在高温下与空气中的氧气、二氧化碳等反应,所以工业上常用金属镁还原TiC14的方法制备Ti,需要在氩气氛围中,防止钛、镁在高温下与空气中的氧气、二氧化碳等反应,
故答案为:防止钛、镁在高温下与空气中的氧气、二氧化碳等反应.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度中等,注意把握实验的基本原理和物质的性质.

| A. | C3H8 | B. | C7H8O | C. | CH4O | D. | CH2Cl2 |
学习小组在进行1-氯丙烷与NaOH乙醇溶液的反应中,观察到有气体生成.
请你设计两种不同的方法分别检验该气体.在答题卡的方框中写出装置中所盛试剂的名称(试剂任选)和实验现象.
| 装置图 | 所盛试剂 | 实验现象 | |
| 1 | 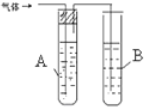 | A是 水 B是 酸性高锰酸钾溶液 | |
| 2 |  | C是 溴的四氯化碳溶液 |

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中B的体积分数增大,乙中B的体积分数减小 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
| A. | 铜和浓硝酸反应 | B. | 工业合成氨的反应 | ||
| C. | 工业制粗硅的反应 | D. | 铜和浓硫酸反应 |



 .
. .
.