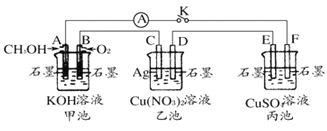
题目内容
【题目】为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42+以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
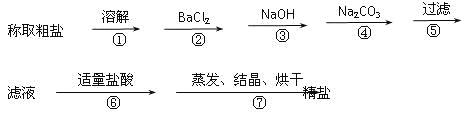
(1)判断BaCl2已过量的方法是_________________________。
(2)第④步中,相关的离子方程式是___________;__________。
(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是_____________。
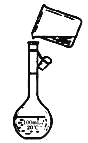
(4)为检验精盐纯度,需配制150 mL.0.2 mol/L NaCl(精盐)溶液,上图是该同学转移溶液的示意图,图中的错误是__________。
【答案】取第②步后的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量 Ca2++ CO32-= CaCO3↓ Ba2++ CO32-= BaCO3↓ 在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度 未用玻璃棒引流;未采用150 mL容量瓶
【解析】
(1)根据钡离子能和硫酸根之间反应生成硫酸钡沉淀来检验氯化钡是否过量;
(2)碳酸钠可以将钙离子以及过量的钡离子沉淀下来;
(3)氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应;
(4)根据容量瓶的使用方法以及移液操作知识来回答。
(1)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是硫酸根剩余,则氯化钡会与其反应出现白色沉淀,所以判断BaCl2已过量的方法是:取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量(或其它合理的方法);
(2)碳酸钠可以将钙离子以及过量的钡离子沉淀下来,反应原理是Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓,
故答案为:Ca2++CO32-=CaCO3↓、Ba2++CO32-=BaCO3↓;
(3)若先用盐酸调pH再过滤,氢氧化镁沉淀、碳酸钙沉淀均会和盐酸反应,将对实验结果产生影响,
故答案为:在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度;
(4)向容量瓶中转移液体时,要用玻璃棒来引流,配制一定体积的溶液要选择一定体积的容量瓶,故答案为:未用玻璃棒引流,未采用100mL容量瓶。

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案【题目】在容积为1 L的恒容密闭容器中充入CO(g)和H2O(g),发生反应:CO(g) + H2O(g)![]() CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
CO2(g) + H2(g) ΔH<0,所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(CO) | n(H2O) | n(CO2) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是
A. 实验①中,若5 min时测得n (CO2) =0.050 mol,则0至5 min时间内,用H2表示的平均反应速率υ (H2) = 5.0×10-2 mol/(L·min)
B. 实验②中,该条件下反应的平衡常数K =2.0
C. 实验③中,达到平衡时,CO的转化率为60%
D. 实验④中,达到平衡时,b>0.060