题目内容
14.铁、铜混合粉末20.0g加入到100mL 5.0mol•L-1FeCl3溶液中,剩余固体质量为5.2g(忽略反应前后溶液体积变化).求:(1)反应后溶液中FeCl2的物质的量浓度6.5 mol•L-1.
(2)原固体混合物中铜的质量分数是58%.
分析 Fe的还原性强于铜,把二者混合物加入FeCl3溶液中,Fe先与Fe3+反应,氯化铁的物质的量为:n(FeCl3)=5.0mol•L-1×0.1L=0.5mol,
Cu+2Fe3+=Cu2++2Fe2+ Fe+2Fe3+=3Fe2+
64g 2mol 56g 2mol
m1 0.5mol m2 0.5mol
则m1=16g,m2=14g,
溶解的金属质量是20-5.2=14.8>14g,说明两种金属都参与反应,且Fe3+完全反应,剩余的金属是Cu;
设反应消耗Cu的物质的量是n1,反应的Fe的物质的量为n2,则
64n1+56n2=14.8g
n1+n2=0.25mol
(1)根据铁元素守恒计算出反应后溶液中氯化亚铁的物质的量,然后根据c=$\frac{n}{V}$计算出氯化亚铁的浓度;
(2)根据m=nM计算出参与反应的Cu的质量,然后计算出混合物中含有铜的总质量及铜的质量分数.
解答 解:Fe的还原性强于铜,把二者混合物加入FeCl3溶液中,Fe先与Fe3+反应,氯化铁的物质的量为:n(FeCl3)=5.0mol•L-1×0.1L=0.5mol,
Cu+2Fe3+=Cu2++2Fe2+ Fe+2Fe3+=3Fe2+
64g 2mol 56g 2mol
m1 0.5mol m2 0.5mol
m1=16g,
m2=14g,
溶解的金属质量是20-5.2=14.8>14g,说明两种金属都参与反应,且Fe3+完全反应,剩余的金属是Cu;
设反应消耗Cu的物质的量是n1,反应的Fe的物质的量为n2,则
64n1+56n2=14.8g
n1+n2=0.25mol
解得:n1=0.1mol、n2=0.15mol,
(1)混合物中的Fe完全反应,根据Fe元素守恒可知,反应后溶液中亚铁离子的物质的量为:0.5mol+0.15mol=0.65mol,反应后溶液中FeCl2的物质的量浓度为:$\frac{6.5mol}{0.1L}$=6.5mol/L,
故答案为:6.5;
(2)原混合金属中含有的铜的质量是:0.1mol×64g/mol+5.2g=11.6g,原混合物中铜的质量分数为:$\frac{11.6g}{20g}$×100%=58%,
故答案为:58%.
点评 本题考查混合物的计算,为高频考点,题目难度中等,侧重于学生的分析能力和计算能力的考查,注意根据反应的相关方程式从质量守恒的角度解答.

| A. |  表示燃料燃烧反应的能量变化 | |
| B. | 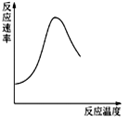 表示酶催化反应的反应速率随反应温度的变化 | |
| C. |  表示可逆反应从加入反应物开始建立化学平衡的过程 | |
| D. | 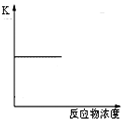 表示可逆反应的平衡常数随反应物浓度的变化 |
| A. | 常温下1.0L 0.1 mol•L-1NH4Cl 溶液中,NH4+和H+总数大于0.1NA | |
| B. | 0.1mol ${\;}_{38}^{90}$Sr原子中含中子数为3.8NA | |
| C. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.3NA | |
| D. | 标准状况下,22.4LCl2参加反应,转移的电子数一定为2NA |
| A. | 1 L 0.1 mol/L的NaHCO3溶液中,HCO3-、CO32-离子数之和为0.1NA | |
| B. | 44 g CO2、N2O组成的混合气体中所含有的原子数为3 NA | |
| C. | 36g3H2中含有的中子数目为24 NA | |
| D. | 2.24 L(标准状况)O2与钠反应时,转移电子数目可能为0.3 NA |
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b}$R |
| A. | 赤铁矿石炼铁 | B. | 氢氟酸刻蚀玻璃 | ||
| C. | 液氨制冷 | D. | 自然界中氮的固定 |
| A. | 实验室制取氯气时浓硫酸作干燥剂 | |
| B. | 浓硫酸加到蔗糖中,蔗糖变黑 | |
| C. | 浓硫酸加到胆矾上,蓝色晶体变为白色粉末 | |
| D. | 浓硫酸使Fe、Al钝化 |
 .
.