题目内容
下列排列顺序正确的是( )
①酸性:H3PO4>H2SO4>HClO4 ②热稳定性:H2O>H2S>PH3
③熔点:MgCl2>SiCl4>SiO2 ④沸点:H2O>HF>HCl.
①酸性:H3PO4>H2SO4>HClO4 ②热稳定性:H2O>H2S>PH3
③熔点:MgCl2>SiCl4>SiO2 ④沸点:H2O>HF>HCl.
| A、②④ | B、①③ | C、①④ | D、②③ |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:①非金属越强,则其最高价氧化物的水化物的酸性越强;
②非金属性越强,则其氢化物的稳定性越强;
③熔点的一般规律:原子晶体>离子晶体>分子晶体;
④含有氢键的氢化物的沸点较高,分子间形成氢键数目越多,沸点越高;
②非金属性越强,则其氢化物的稳定性越强;
③熔点的一般规律:原子晶体>离子晶体>分子晶体;
④含有氢键的氢化物的沸点较高,分子间形成氢键数目越多,沸点越高;
解答:
解:①非金属越强,则其最高价氧化物的水化物的酸性越强,非金属性:P<S<Cl,则酸性:H3PO4<H2SO4<HClO4,故错误;
②非金属性越强,则其氢化物的稳定性越强,非金属性:O>S>P,则热稳定性:H2O>H2S>PH3,故正确;
③熔点的一般规律:原子晶体>离子晶体>分子晶体,所以熔点:SiO2>MgCl2>SiCl4,故错误;
④含有氢键的氢化物的沸点较高,分子间形成氢键数目越多,沸点越高,所以沸点:H2O>HF>HCl,故正确;
所以正确的有②④;
故选A.
②非金属性越强,则其氢化物的稳定性越强,非金属性:O>S>P,则热稳定性:H2O>H2S>PH3,故正确;
③熔点的一般规律:原子晶体>离子晶体>分子晶体,所以熔点:SiO2>MgCl2>SiCl4,故错误;
④含有氢键的氢化物的沸点较高,分子间形成氢键数目越多,沸点越高,所以沸点:H2O>HF>HCl,故正确;
所以正确的有②④;
故选A.
点评:本题考查了元素性质的递变规律,题目难度不大,注意把握非金属元素的性质的变化规律.

练习册系列答案
相关题目
下列有关NA的说法不正确的是( )
| A、标况下1mol HF 的体积约为22.4 L |
| B、1.44g CaO2中所含阴离子数目为0.02NA |
| C、标况下4.48L CO2中含有的共用电子对数目为0.8NA |
| D、标准状况下,11.2L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
 炭雕(如图所示)是一种集观赏与空气净化为一体的产品,这种产品可对车内及室内空气中的一氧化碳、苯、甲醛、烟雾等有害气体进行有效吸附.取一块制作炭雕的下脚料,进行下面的实验.下列有关叙述不正确的是( )
炭雕(如图所示)是一种集观赏与空气净化为一体的产品,这种产品可对车内及室内空气中的一氧化碳、苯、甲醛、烟雾等有害气体进行有效吸附.取一块制作炭雕的下脚料,进行下面的实验.下列有关叙述不正确的是( )| A、将炭雕下脚料在空气中点燃,可以得到使澄清石灰水变浑浊的气体 |
| B、将炭雕下脚料研成粉末,加入到稀的红墨水中,红墨水褪色 |
| C、将炭雕下脚料研成粉末,与氧化铜粉末混合加热,可以得到红色固体 |
| D、将炭雕下脚料加入到盛有氯气的集气瓶中,静置一段时间,黄绿色变浅,其原因是炭雕下脚料中的物质与氯气发生氧化还原反应 |
25℃时,a mol?L-1 HCl溶液与b mol?L-1一元碱BOH等体积混合后,pH为7,则下列关系可能正确的是( )
| A、a>b |
| B、a<b |
| C、c(Cl-)>c(B+) |
| D、c(Cl-)<c(B+) |
下列与化学概念有关的说法正确的是( )
| A、化合反应均为氧化还原反应 |
| B、催化剂能改变可逆反应达到平衡的时间 |
| C、金属氧化物均为碱性氧化物 |
| D、石油是混合物,其分馏产品汽油为纯净物 |
一定条件下发生化学反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.现有容积均为1L的甲、乙、丙、丁四个容器,在上述条件下分别充入气体,到达平衡时,反应放出的热量(Q),及平衡时的转化率(X)如下表所示:
下列叙述正确的是( )
| 容器 | 起始时各物质的量(mol) | 到达平衡时放出 的热量(QkJ) |
平衡时SO2转化率(X) | |||
| SO2 | O2 | SO3 | N2 | |||
| 甲 | 2 | 1 | 0 | 0 | Q1 | X1 |
| 乙 | 1 | 0.5 | 0 | 0 | Q2=39.4 | X2 |
| 丙 | 1 | 0.5 | 0 | 1 | Q3 | X3 |
| 丁 | 1.8 | 0.9 | 0.2 | 0 | Q4 | X4 |
| A、Q1=78.8 |
| B、Q1=Q4>Q2=Q3 |
| C、X1>X3=40% |
| D、X1=X4>X2=X3 |
下列关于范德华力的叙述中,正确的是( )
| A、范德华力的实质也是一种电性作用,所以范德华力是一种特殊化学键 |
| B、任何分子间在任意情况下都会产生范德华力 |
| C、范德华力与化学键的区别是作用力的强弱问题 |
| D、范德华力非常微弱,故破坏范德华力不需要消耗能量 |
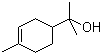 )的分子式为
)的分子式为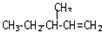 一定条件发生加聚反应时的化学方程式
一定条件发生加聚反应时的化学方程式