题目内容
5.合成氨反应N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g)在某温度下达到平衡时,各物质的浓度是c(N2)=3mol•L-1,c(H2)=9mol•L-1,c(NH3)=4mol•L-1求:
①该温度时的平衡常数;
②N2、H2的起始浓度.
分析 N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g)
开始 x y 0
转化 2 6 4
平衡 3 9 4
①K为生成物浓度幂之积与反应物浓度幂之积的比,结合平衡浓度计算;
②起始浓度=转化浓度+平衡浓度.
解答 解:N2(g)+3H2(g)$?_{催化剂}^{高温、高压}$2NH3(g)
开始 x y 0
转化 2 6 4
平衡 3 9 4
①该温度时的平衡常数K=$\frac{{4}^{2}}{3×{9}^{3}}$=0.007(mol/L)-2,
答:该温度时的平衡常数K为0.007(mol/L)-2;
②N2的起始浓度为2mol/L+3mol/L=5mol/L,H2的起始浓度为6mol/L+9mol/L=15mol/L,
答:N2、H2的起始浓度分别为5mol/L、15mol/L.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K的计算为解答的关键,侧重分析与计算能力的考查,注意利用平衡浓度计算K,题目难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案
相关题目
13. 已知:乙醇、1,2-二溴乙烷、乙醚的有关物理性质如下表所示
已知:乙醇、1,2-二溴乙烷、乙醚的有关物理性质如下表所示
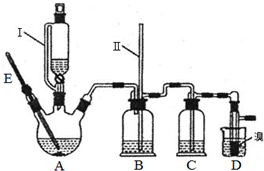
某化学小组拟用乙醇、溴等为原料在实验室制备少量的1,2一二溴乙烷,实验装置如图所示(装置A中的加热部分的仪器装置省略没有画出).
(1)实验中仪器E的最佳示数为170℃;
加热反应过程中,三颈烧瓶里除生成乙烯外,还可能生成的有机副产物主要是乙醚;
(2)仪器Ⅰ是漏斗,其左部的玻璃管的作用是A(填字母).
A.使漏斗中液体容易滴下
B.有利于吸收气体杂质
C.防止A中三颈烧瓶里的液体爆沸
(3)反应过程中,若B中长玻璃导管(Ⅱ)里的液面上升,则说明可能是由于D中出现堵塞(填“D中出现堵塞”或“C中杂质已除尽”)造成的.
(4)说明制备1,2-二溴乙烷的反应已经结束的实验现象是D中液溴的颜色褪去或D中试管里的液体呈无色;
(5)为验证乙烯具有还原性,可将D装置中的溴换成C(填字母);
A.新制Cu(OH)2悬浊液 B.银氨溶液 C.KMnO4溶液 D.FeCl2溶液
某学生认为若无C除杂,就不能检验乙烯具有还原性,其理由因为乙醇、SO2等具有还原性,也可以使酸性KMnO4溶液褪色.
 已知:乙醇、1,2-二溴乙烷、乙醚的有关物理性质如下表所示
已知:乙醇、1,2-二溴乙烷、乙醚的有关物理性质如下表所示| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 通常状况下的状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 熔点/℃ | -130 | 9 | -116 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
(1)实验中仪器E的最佳示数为170℃;
加热反应过程中,三颈烧瓶里除生成乙烯外,还可能生成的有机副产物主要是乙醚;
(2)仪器Ⅰ是漏斗,其左部的玻璃管的作用是A(填字母).
A.使漏斗中液体容易滴下
B.有利于吸收气体杂质
C.防止A中三颈烧瓶里的液体爆沸
(3)反应过程中,若B中长玻璃导管(Ⅱ)里的液面上升,则说明可能是由于D中出现堵塞(填“D中出现堵塞”或“C中杂质已除尽”)造成的.
(4)说明制备1,2-二溴乙烷的反应已经结束的实验现象是D中液溴的颜色褪去或D中试管里的液体呈无色;
(5)为验证乙烯具有还原性,可将D装置中的溴换成C(填字母);
A.新制Cu(OH)2悬浊液 B.银氨溶液 C.KMnO4溶液 D.FeCl2溶液
某学生认为若无C除杂,就不能检验乙烯具有还原性,其理由因为乙醇、SO2等具有还原性,也可以使酸性KMnO4溶液褪色.
10.现有一瓶A和B的混合液,已知它们的性质如表.
据此分析,将A和B分离的常用方法是( )
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
| A. | 蒸馏 | B. | 分液 | C. | 过滤 | D. | 蒸发 |
 .
.
 欲配制250mL0.1mol•L-1的H2SO4溶液,回答下列有关问题,有如下操作步骤:
欲配制250mL0.1mol•L-1的H2SO4溶液,回答下列有关问题,有如下操作步骤: