题目内容
4.同周期的X、Y、Z三种元素,它们最高价氧化物对应水化物分别是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )| A. | 含氧酸的酸性H3ZO4>H2YO4>HXO4 | |
| B. | HXO4、H2YO4、H3ZO4一定都是强酸 | |
| C. | 元素的负化合价的绝对值按X、Y、Z减小 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序减弱 |
分析 同周期的X、Y、Z三种主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价分别为+7、+6、+5,则原子序数X>Y>Z,
A.同周期自左而右非金属性增强,非金属性越强,最高价含氧酸的酸性越强;
B.三种元素可能为P、S、Cl,P对应的酸为中强酸磷酸;
C.最低负化合价=最高正化合价-8;
D.非金属性越强,氢化物越稳定.
解答 解:同周期的X、Y、Z三种主族元素,它们最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则X、Y、Z的最高正化合价分别为+7、+6、+5,则原子序数X>Y>Z,
A.同周期自左而右非金属性增强,故非金属性X>Y>Z,非金属性越强,最高价含氧酸的酸性越强,故含氧酸的酸性强弱为:H3ZO4<H2YO4<HXO4,故A错误;
B.Z可能为P元素,则H3ZO4为H3PO4,磷酸为中强酸,不是强酸,故B错误;
C.X、Y、Z最低负化合价分别为-1、-2、-3,负化合价的绝对值依次增大,故C错误;
D.非金属性X>Y>Z,非金属性越强,氢化物越稳定,故氢化物稳定性按X、Y、Z顺序由强到弱,故D正确;
故选D.
点评 本题考查原子结构与元素周期律的应用,题目难度中等,侧重对元素周期律的知识,注意理解掌握同周期元素性质递变规律,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
相关题目
14.已知拆开1mol氢气中的化学键需要消耗436.4KJ能量,拆开1mol氧气中的化学键需要消耗498KJ能量,形成水分子中的1molH-O键能够释放462.8KJ能量,则反应2H2(g)+O2(g)=2H2O(g)的能量变化是( )
| A. | 吸收445.2KJ | B. | 吸收480.4KJ | C. | 放出445.2KJ | D. | 放出480.4KJ |
15.如图所示原电池装置中,电解质溶液为硫酸,下列有关叙述错误的是( )
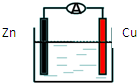

| A. | 锌做负极发生氧化反应 | |
| B. | 供电时的总反应为:Zn+2H+=Zn2++H2↑ | |
| C. | 该装置可实现化学能转化为电能 | |
| D. | 溶液中硫酸根离子向Cu极移动 |
12.羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)?COS(g)+H2(g) K=0.1,反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
| A. | 升高温度,H2S浓度增加,表明该反应是放热反应 | |
| B. | 通入CO后,正反应速率逐渐增大 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为80% |
19.高炉炼铁中发生的主要反应为Fe2O3+3CO$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2,下列有关该反应的说法正确( )
| A. | 该反应属于置换反应 | B. | CO作还原剂 | ||
| C. | Fe2O3发生氧化反应 | D. | CO被还原 |
16.下表是部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nmm | 0.160 | 0.134 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | L与T形成的化合物具有两性 | ||
| C. | L和Q金属性:Q<L | D. | 氢化物的稳定性为H2T<H2R |
14.已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4.则下列说法不正确的是( )
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | |
| B. | 非金属活泼性:Z<Y<X | |
| C. | 单质的氧化性:X2>Y>Z | |
| D. | X与Z形成的化合物均能达8电子稳定结构 |
