题目内容
【题目】实验室中有一未知浓度的稀盐酸,某同学在实验室中通过酸碱中和滴定实验测定盐酸的浓度。取20.00 mL待测盐酸放入锥形瓶中,并滴加23滴酚酞作指示剂,用标准的NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度(molL-1) | 滴入NaOH溶液的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.10 | 20.00 |
2 | 0.10 | 22.00 | 20.00 |
3 | 0.10 | 21.90 | 20.00 |
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是_____________________。
(2)该实验滴定达到终点的标志是__________________________。
(3)根据上述数据,可计算出该盐酸的浓度约为_________。(保留两位有效数字)
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_________。
A滴定终点读数时俯视读数
B滴定过程中,不小心滴到桌子上几滴
C碱式滴定管尖嘴部分有气泡,滴定后消失
D锥形瓶水洗后未干燥
【答案】用标准的NaOH溶液进行润洗2~3次 加入最后一滴NaOH溶液,锥形瓶内溶液由无色变为浅红色,且30s内不恢复原色 0.11mol/L BC
【解析】
(1)滴定管用蒸馏水洗涤后,还必须用待装液润洗,否则影响待装液的浓度;
(2)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(3)先判断数据的合理性,求出标准NaOH溶液体平均体积,然后依据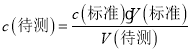 求出即可;
求出即可;
(4)根据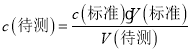 分析不当操作对V (标准) 的影响,以此判断浓度的误差;
分析不当操作对V (标准) 的影响,以此判断浓度的误差;
(1)碱式滴定管用蒸馏水洗净后,为了不影响氢氧化钠溶液的浓度,应该用标准NaOH溶液润洗2~3次;
(2)滴定时,当溶液颜色变化且半分钟内不变色,可说明达到滴定终点,酚酞在酸中为无色,在碱性溶液中显浅红色,所以达到滴定终点现象:当滴入最后一滴氢氧化钠溶液时,溶液由无色恰好变成浅红色,且半分钟内不褪色;
(3)三组数据都有效,则消耗标准液平均体积为:V(标准)=![]() =22.00mL,由
=22.00mL,由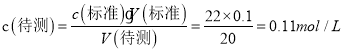 ,
,
故答案为:0.11mol/L;
(4) A、滴定终点读数时俯视读数,导致消耗标准液体积偏小,依据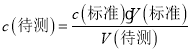 可知,测定结果偏低;
可知,测定结果偏低;
B、滴定过程中,不小心滴到桌子上几滴,导致消耗标准液体积偏大,依据 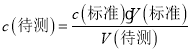 可知,测定结果偏大;
可知,测定结果偏大;
C、碱式滴定管尖嘴部分有气泡,滴定后消失,导致消耗标准液体积偏大,依据 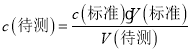 可知,测定结果偏大;
可知,测定结果偏大;
D、锥形瓶水洗后未干燥,对消耗标准液体积不产生影响,依据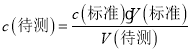 可知,测定结果不变;
可知,测定结果不变;
故选BC。

 云南师大附小一线名师提优作业系列答案
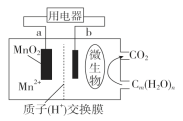
云南师大附小一线名师提优作业系列答案【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用溢流法连续制备无水四氯化锡,实验装置图如图:
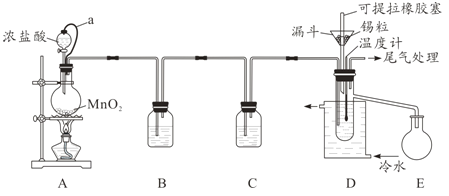
查阅资料可知:
①Sn(s)+2Cl2(g)=SnCl4(l) ΔH=-511kJ/mol
②SnCl4易挥发,极易发生水解。
③相关物质的物理性质如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
密度/g·cm-3 | 7.310 | 2.226 | 3.386 |
回答下列问题:
(1)a管的作用是__________。
(2)A中反应的离子方程式是__________。
(3)D中冷却水的作用是________________。
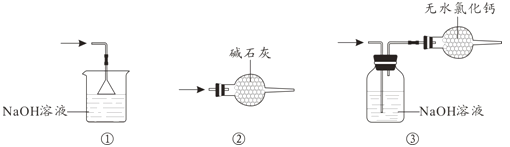
(4)尾气处理时,可选用的装置是__________(填序号)。
(5)锡粒中含铜杂质致D中产生CuCl2,但不影响E中产品的纯度,原因是________。
(6)制得的SnCl4产品中常含有SnCl2,可用如下方法测定产品纯度:先准确称量7.60g产品于锥形瓶中,再加过量的FeCl3溶液,发生反应:SnCl2+2FeCl3=SnCl4+2FeCl2,再用0.1000mol/LK2Cr2O7标准溶液滴定生成的Fe2+,此时还原产物为Cr3+,消耗标准溶液20.00mL,则SnCl4产品的纯度为__________。
【题目】常温下,1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最稳定的共价键是H-F
B. 1mol H2(g)与1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量